プレスリリース 自然免疫の外来DNAセンサーcGASが自己の染色体DNAに反応しないメカニズムを解明―ウイルス感染症防御、自己免疫疾患、癌、神経変性疾患などの疾患の原因解明への一歩―
プレスリリース
東京大学定量生命科学研究所
日本医療研究開発機構
発表者
鯨井智也(東京大学定量生命科学研究所 クロマチン構造機能研究分野 助教)
発表のポイント
- 自然免疫におけるDNAセンサーcGAS(注1)が、自己の染色体DNAによって不活化されるメカニズムを解明しました。
- DNAとヌクレオソーム(注2)の共存下では、cGASがDNAではなくヌクレオソームに選択的に結合することで、自身の免疫及び炎症反応を誘導する活性を抑制します。
- cGASは、ウイルス感染症、自己免疫疾患、癌、老化、神経変性疾患など、多岐にわたる疾病に関与していることから、これらの疾患の原因解明や治療法確立への応用が期待されます。
発表概要
胡桃坂仁志教授ら東京大学定量生命科学研究所のグループは、米国ロックフェラー大学の船引宏則教授らのグループと共同で、自然免疫におけるDNAセンサーcGASが、自己の染色体DNAによって不活化されるメカニズムを解明しました。
生物は、ウイルスなどの外来の微生物に対する防衛策として自然免疫機構を備えています。この機構で中心的な役割を担うのが、cGAS(cyclic GMP-AMP synthase)-STING(stimulator of interferon genes)経路です。この経路では、外来の非自己DNAが細胞に侵入すると、DNAセンサーであるcGASが結合して活性化し、STINGを通じて炎症反応が誘起されます。一方で細胞内には、自己の設計図である染色体DNAが存在するため、自己のDNAに対する免疫応答を回避するためにcGASは染色体DNAに対しては常に不活性化されている必要があります。船引宏則教授らによる近年の研究から、cGASが染色体の基本単位であるヌクレオソームに結合すると、cGASのDNAに対する応答反応が不活化されることが報告され、これにより自己免疫応答が回避されることがわかってきました。しかし、その詳細なメカニズムは不明でした。
本研究チームは、最新のクライオ電子顕微鏡(注3)による立体構造解析と生化学的解析とを組み合わせて、cGASがヌクレオソームにより不活化される分子メカニズムを解明しました。具体的には、cGASとヌクレオソームが結合した複合体を試験管内で再構成し、その立体構造をクライオ電子顕微鏡により解析することで、cGASがヌクレオソームによって不活性化されている様子を捉えました。その結果、cGASの活性化に必要な、3つのDNA結合領域と二量体形成領域のすべてがヌクレオソームによってブロックされることを発見しました。そして、立体構造情報に基づき変異体解析を行った結果、cGASのヌクレオソーム結合領域の変異によって、ヌクレオソームによるcGASの不活化が損なわれ、自己免疫応答の状態になることがわかりました。
本研究は、国立研究開発法人日本医療研究開発機構(AMED)の創薬等ライフサイエンス研究支援基盤事業(BINDS)「エピジェネティクス研究と創薬のための再構成クロマチンの生産と性状解析」(代表:胡桃坂仁志、JP20am0101076)、日本学術振興会(JSPS)の新学術領域研究「遺伝子制御の基盤となるクロマチンポテンシャル」における「ヌクレオソーム高次構造とダイナミクスの解析によるクロマチン潜在能の解明」(代表:胡桃坂仁志、JP18H05534)、若手研究「自然免疫DNAセンサーによるクロマチンの認識と構造制御機構の解明」(代表:鯨井智也、JP20K15711)、および科学技術振興機構(JST)の戦略的創造研究推進事業(ERATO)「胡桃坂クロマチンアトラスプロジェクト」(総括:胡桃坂仁志、JPMJER1901)の支援を受けて実施されました。
本研究成果は、2020年9月10日(米国東部標準時)に米国科学誌「Science」のオンライン速報版に掲載されます。
発表内容
研究の背景と経緯
生物は、ウイルスなどをはじめとする外来の微生物に対する防衛策として自然免疫を備えています。この機構として、ヒトを始めとする高等動物では、外来DNAを検知し免疫及び炎症反応を誘起するcGAS(cyclic GMP-AMP synthase)-STING(stimulator of interferon genes)経路が中心的役割を果たしています。この経路では、まずcGASが外来DNAに結合して活性化し、cGAMPというシグナル伝達物質を合成します。そして、STINGがcGAMPを認識してその後に続く経路を活性化し、インターフェロンを含む免疫及び炎症反応の遺伝子産物が産生されます。cGASには3つのDNA結合サイトA、B、Cがあり、cGASは二量体化しつつ、これらのDNA結合部位を介してDNAに結合することで活性化します(図1左)。
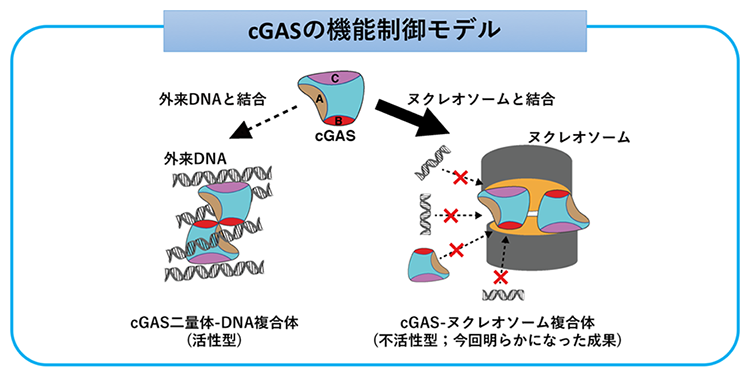
一方で細胞内には、自己の遺伝情報(設計図)である染色体DNAが存在します。自己の染色体DNAにcGASが反応すると自己免疫疾患となってしまうため、cGASは染色体DNAに対しては常に不活化されている必要があります。近年、ウイルス感染防御のみならず、cGASが自己免疫疾患や癌、老化、神経変性疾患をはじめとする広範な疾病に関与することが次々と報告され、cGASによる自己、外来DNAの認識機構の解明が今まさに期待されていました。
染色体の基盤構造であるヌクレオソームは、4種類のヒストンタンパク質からなるヒストン8量体にDNAが1.7回巻きつくことで形成されています。染色体は、このヌクレオソームがDNAによって数珠状に連なったものです。これまでに、cGASがヌクレオソームに結合すると、cGASの活性が不活化されることが報告されており、これにより自己免疫応答が回避される可能性が考えられていました。しかし、その不活化の詳細なメカニズムは未だ不明でした。
研究の内容
東京大学定量生命科学研究所の胡桃坂仁志教授、鯨井智也助教らの研究グループは、米国ロックフェラー大学の船引宏則教授、Christian Zierhut博士らと共同で、最新のクライオ電子顕微鏡を用いた立体構造解析を中心に、生化学的解析とを組み合わせることで、cGASがヌクレオソームによって不活化される分子メカニズムを解明しました。
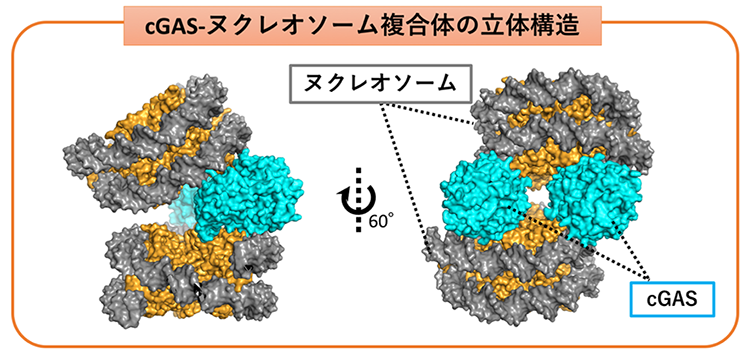
まず本研究では、cGASとヌクレオソームの複合体を試験管内で再構成しました。そして、クライオ電子顕微鏡解析によって、cGASがヌクレオソームによって不活化されている様子を捉えることに世界で初めて成功しました。その結果、2つのcGAS分子が、2つのヌクレオソームに挟まれるように結合するという、サンドイッチのような構造をとっていることが明らかになりました(図2)。この構造において、cGASの活性化に必須である3つのDNA結合サイトA、B、Cと二量体形成領域のすべてが、ヌクレオソームとの結合によってブロックされていることがわかりました(図1右)。これらcGASの3つのDNA結合サイトのうちBサイトは、ヌクレオソーム内のDNAではなくヒストンと直接結合することが明らかになりました。この発見により、DNAとヌクレオソームの共存下では、cGASがDNAではなくヌクレオソームに選択的に結合することで、自身の免疫及び炎症反応を誘導する活性を抑制することがわかりました。実際、ヒストンとの結合が欠損した変異では、DNAによるcGAS活性化をヌクレオソームが阻害できなくなりました。このことは、cGAS変異によるヌクレオソーム結合の欠損が、自己免疫疾患の原因となることを示唆しています。
今後の展開
cGASは、外来の微生物に対応するために中心的な役割を担っていますが、同時に、外来DNAと自己DNAを厳密に区別しなければ自己免疫疾患を引き起こしてしまいます。実際、cGASは自己免疫疾患、癌、老化、神経変性疾患をはじめとする、非常に広範な疾病に関与することが急速に明らかになりつつあり、cGASの機能の解明が、基礎生物学だけでなく、医学・薬学分野から期待されています。
今回の研究から、cGASがヌクレオソームによって不活性化されるメカニズムとして、cGASの活性化に必要な3つのDNA結合サイトおよび二量体形成領域がすべてブロックされる、ということが明らかになりました。本成果は、cGASが自己の染色体DNAと外来DNAを見分ける機構という、自然免疫の中心的な問いに対して答えを与えるものです。加えて今回の発見は、cGASが関連する広範な疾患の原因解明や治療法確立のために重要な情報を提供すると考えられます。
発表雑誌
- 雑誌名
- Science
- 論文タイトル
- Structural basis for the inhibition of cGAS by nucleosomes
- 著者
- Tomoya Kujirai†, Christian Zierhut†, Yoshimasa Takizawa, Ryan Kim,Lumi Negishi, Nobuki Uruma, Seiya Hirai, Hironori Funabiki*, Hitoshi Kurumizaka*
(※第一著者に†、責任著者に*)
用語解説
- (注1)cGAS
- DNAに結合すると活性化し、cGAMPというシグナル伝達物質を合成することで、自然免疫を活性化する酵素。ウイルスなどの外来DNAに対するセンサーとして働く。
- (注2)ヌクレオソーム
- 染色体の最小単位。DNAを折りたたむ基盤となる構造。ヒストンタンパク質で作られるコアに、DNAが左巻きに1.7回転巻きついている。
- (注3)クライオ電子顕微鏡
- サンプルを氷に埋め込んだ状態で、電子顕微鏡によって生体高分子の立体構造を解析する手法。2017年に開発者らがノーベル化学賞を受賞したことでも知られている。
お問い合わせ先
研究に関すること
東京大学定量生命科学研究所
教授 胡桃坂仁志(クルミザカヒトシ)
〒113-0032 東京都文京区弥生1-1-1
TEL:03-5841-7826 FAX:03-5841-1468
E-mail:kurumizaka“AT”iqb.u-tokyo.ac.jp
報道担当
東京大学定量生命科学研究所 総務チーム
〒113-0032 東京都文京区弥生1-1-1
TEL:03-5841-7813
E-mail:soumu“AT”iqb.u-tokyo.ac.jp
AMED事業について
日本医療研究開発機構(AMED)創薬事業部医薬品研究開発課
創薬等ライフサイエンス研究支援基盤事業(BINDS)
TEL:03-6870-2219 FAX:03-6870-2244
E-mail:20-DDLSG-16“AT”amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
関連リンク
掲載日 令和2年9月11日
最終更新日 令和2年9月11日


