プレスリリース AI画像認識により細胞の老化度をスコア化、血管老化を抑制する薬剤候補同定に成功―高速で低コストな大規模創薬スクリーニングを実現―
プレスリリース
慶應義塾大学医学部
日本医療研究開発機構
慶應義塾大学医学部内科学(循環器)教室の湯浅慎介専任講師、同予防医療センターの楠本大助教らの研究グループは、人工知能(AI)を用いた新しい創薬スクリーニング手法(Deep-SeSMo:ディープセスモ)の開発を行い、血管内皮細胞の老化を抑制する薬剤候補を同定することに成功しました。
近年、AIの発展により様々な問題が新たに解決可能となり、AIは多くの分野で社会に組み込まれるようになりました。特に、画像解析の分野では人間を超える精度で認識・判定が可能となり、医学・生物学分野においても大きな発展が期待されています。本研究グループは、まずAIの中でも画像解析に特化した畳み込みニューラルネットワーク(注1)を用いて、培養血管内皮細胞(注2)の顕微鏡写真のみから細胞の老化度合いを評価することができるシステム(Deep-SeSMo;ディープセスモ)の開発を行いました。さらに同システムを応用して化合物のスクリーニング(注3)を行い、老化抑制効果を有する薬剤候補の同定に成功しました。
従来、化合物スクリーニングを行うためには、細胞が病的状態にあることを評価するために複雑な分子生物学的手法を用いる必要があり、これに伴う膨大な手間と費用が大規模スクリーニングの障壁となっていました。今回研究グループが開発したDeep-SeSMoは画像1枚につきわずか0.1ミリ秒で評価可能であり、本システムの導入により従来よりもはるかに高速かつ簡便に、信頼性の高い創薬スクリーニングが可能となりました。本システムを応用することで、他の様々な病気に対する新規治療薬開発も加速することが期待されます。
本成果で同定された薬剤候補化合物について今後さらに研究を進めることにより、老化コントロールを目的とした治療薬開発につなげていきます。また血管老化などに起因する心筋梗塞や心不全などの様々な疾患に対する画期的な治療薬の開発につながることが期待されます。
本研究成果は、2021年1月11日(ロンドン時間)に英国科学誌『Nature Communications』オンライン版に公開されました。
研究の背景
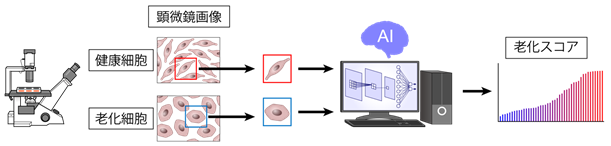
AIは近年急激な進歩を遂げています。特に畳み込みニューラルネットワークを用いた画像解析の進歩は著しく、人間でも判別困難な画像ですら正しく認識・判定することが可能となりました。AIは既に自動運転、顔認証など様々な分野に応用されていますが、医学・生物学分野への広い応用も期待されています。我々は、これまでにヒトiPS細胞から分化誘導した様々な細胞の顕微鏡写真から、AIを用いて血管内皮細胞を自動認識する方法を確立し報告しました(Kusumoto D, Lachmann M, Kunihiro T, et al. Stem Cell Reports. 2018)。その自動認識の精度は非常に良く、AIを用いた細胞顕微鏡画像の自動認識システムをさらに幅広く応用することが可能ではないかと考えました。従来、様々な病気の治療薬を開発する過程で、有効な薬剤を探索するスクリーニング(注3)を行うためには、細胞内の病的状態を反映するような分子マーカーを用いて、病的細胞に薬剤を投与し細胞の状態が改善しているかを判別する必要がありました。しかし有効なマーカーが存在しない場合もあり、また有効なマーカーがある場合でも判別に要する手間や費用といったコストが大きく、大規模かつスムーズな薬剤探索への障壁となっていました。病的細胞は、健康細胞と形が異なることが知られていますが、顕微鏡写真のみを見て判断することは、熟練した研究者にも困難であり、これまでは細胞の形態の違いを薬剤開発の指標にすることはできませんでした。そこで我々は、AIによる画像解析で健康細胞の形と病的細胞(老化細胞)の形を学習(注4)させ、高い精度で二者を判別することで、顕微鏡写真の細胞形態を指標に化合物スクリーニングを行うことを可能とし、分子マーカーを必要としない新規の化合物スクリーニングシステムを開発することを考えました(図1)。
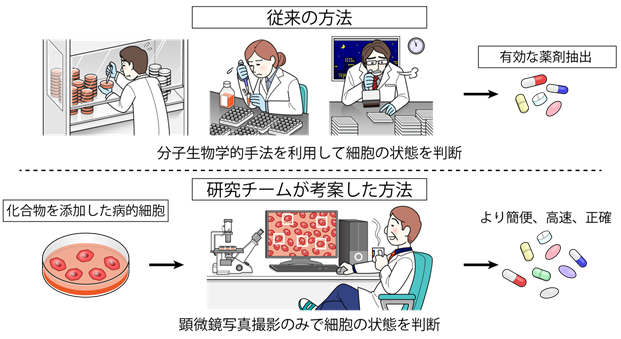
近年、人間の老化に伴って発症頻度が増える加齢関連疾患は増加しており、世界での主要な死因を占めています。循環器疾患など様々な疾患において、加齢は最も強い危険因子であり、その制御による治療や予防が強く期待されています。現在、加齢に直接介入する方法としては生活スタイルや食事の管理が中心であり、根本的な治療法は存在しません。人間の老化は、生体の構成成分である細胞が老化することが原因となっており、細胞老化を抑制することが、加齢関連疾患の発症抑制につながることが近年の研究で分かってきています。老化細胞は、健康細胞と比べて特徴的な形態を示していることが知られていることから、本研究ではAIを用いて、細胞の顕微鏡写真を入力するだけで高速、簡便かつ高精度で実行可能な化合物スクリーニングシステムを構築し、老化を抑制するような薬剤候補化合物を発見することを目的としました。
研究の概要と成果
本研究では、特に加齢関連疾患の中でも全ての臓器の老化に関与している血管老化に着目し、培養血管内皮細胞を用いて老化細胞の作成を行いました。健康細胞と老化細胞の顕微鏡写真を撮影し、畳み込みニューラルネットワークを用いて学習を行い、健康細胞と老化細胞を正答率95%程度の高精度で判別可能な画像認識システムを開発しました。さらに、細胞の老化判定を行う畳み込みニューラルネットワークを用い、入力した細胞画像の老化の確率を出力することで細胞がどの程度老化しているかということを定量的にスコア化するシステムの開発に成功しました(Deep-SeSMo:ディープセスモ;図2)。このスコアを指標として、化合物のスクリーニングを行いました。
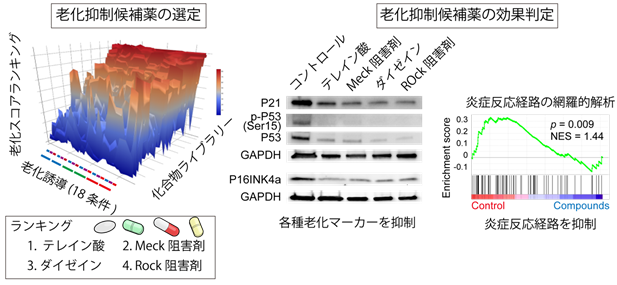
本システムを用いると、老化状態を反映する分子マーカーを必要とせず、撮影した顕微鏡画像から細胞がどの程度老化しているかをわずか0.1ミリ秒で判定可能となるので、手間、時間や費用を大きく抑えたスクリーニングシステムとなることが判明しました。実際に細胞老化を抑制する作用もあるとされている化合物(メトホルミンなど)による抗老化の効果も正しく判定できることが確認されました。本システムを用いて化合物ライブラリーを用いてスクリーニングし、テレイン酸、Rock阻害剤、大豆イソフラボンの一種であるダイゼイン、MEK阻害剤などの薬剤を新規の老化抑制の薬剤候補として抽出することが出来ました(図3)。これらの化合物を培養血管内皮細胞に添加すると、老化細胞染色として知られているSAベータガラクトシダーゼ染色、また老化細胞で上昇しているとされるP21、P16タンパク発現量、P53タンパクのリン酸化がいずれも抑制されることがわかりました。さらに、遺伝子の網羅的な発現解析を行うと、老化細胞から惹起される炎症反応が抑制されており、加齢関連疾患につながる悪玉シグナルも同時に抑制されることが判明しました(図3)。以上のように、AIによる新たなスクリーニング手法を開発し、老化を抑制する薬剤候補化合物を同定しました。
研究の意義・今後の展望
本研究で開発されたDeep-SeSMoは、分子マーカーを使用せずに、培養細胞の顕微鏡写真のみを使用して、高速で高精度な化合物スクリーニングを行うことが可能です。実際に本研究を通じて4つの老化抑制の薬剤候補化合物を同定し、これらの薬はいずれも他の研究からも老化を抑制する効果が期待されていることから、加齢関連疾患に対する根本的な治療法となる可能性を秘めており、さらなる検証が望まれます。さらに、本研究は、疾患の化合物スクリーニングに対する手法としてAIによる画像解析が有用であることを実証したものであり、細胞形態の変化を特徴とする様々な疾患に対して応用可能です。今後、本システムを応用した創薬スクリーニングが次々と行われ、治療薬開発を活性化させることが期待されます。
特記事項
本研究は、国立研究開発法人日本医療研究開発機構 再生医療実現拠点ネットワークプログラム 技術開発個別課題「多能性幹細胞由来細胞種の自動判別法の確立とその応用」、JSPS科研費JP19K08549、慶應義塾学事振興資金(湯浅)、坂口光洋記念慶應義塾医学振興基金医学研究助成事業(楠本)、日本循環器学会(楠本)の支援によって行われました。
論文名
- 英文タイトル
- “Anti-senescent drug screening by deep learning-based morphology senescence scoring”
- タイトル和訳
- ディープラーニングにより作成された老化形態スコアを用いた老化抑制薬スクリーニング
- 著者名
- 楠本大、関倫久、澤田拓宗、國富晃、勝木俊臣、木村舞、伊藤章吾、小室仁、橋本寿之、福田恵一、湯浅慎介
- 掲載誌
- 「Nature Communications」オンライン版
- DOI
- 10.1038/s41467-020-20213-0
用語解説
- (注1)畳み込みニューラルネットワーク
- 人工知能による画像の解析を行う場合、画像を入力するだけで自動的に結果を判定するシステムが用いられます。畳み込みニューラルネットワークは、画像解析において人間より高い精度での判定が可能であることが近年話題となっています。
- (注2)培養血管内皮細胞
- 血管の最も内側を覆う細胞を、血管内皮細胞といいます。血管内皮細胞が老化することで、様々な臓器が老化することが知られており、加齢に伴う疾患が進行する鍵として知られています。血管内皮細胞を体内から取り出し、培養皿の上で扱うことができるようにした細胞を培養血管内皮細胞といいます。
- (注3)化合物スクリーニング
- 病気の治療薬や、様々な目的に応じた薬剤を探索する際に、多数の化合物(ライブラリー)から目的にあった化合物を探す方法を化合物スクリーニングといいます。
- (注4)学習
- 人工知能に、画像の特徴を覚えさせる作業のことを学習と言います。本研究では、老化細胞の形状にある特徴を学習させることで化合物スクリーニングを可能としました。
お問い合わせ先
本発表資料のお問い合わせ先
慶應義塾大学医学部 予防医療センター
助教 楠本大(くすもとだい)
TEL:03-5843-6702 FAX:03-5363-3875
E-mail:d-kusumoto“AT”keio.jp
慶應義塾大学医学部内科学(循環器)教室
専任講師 湯浅慎介(ゆあさしんすけ)
TEL:03-5843-6702 FAX:03-5363-3875
E-mail:yuasa“AT”keio.jp
本リリースの配信元
慶應義塾大学信濃町キャンパス総務課:山崎・飯塚
〒160-8582 東京都新宿区信濃町35
TEL:03-5363-3611 FAX:03-5363-3612
E-mail:med-koho“AT”adst.keio.ac.jp
慶應義塾大学医学部・医学研究科
事業に関するお問い合わせ先
日本医療研究開発機構
再生・細胞医療・遺伝子治療事業部 再生医療研究開発課
TEL:03-6870-2220
E-mail:saisei“AT”amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
関連リンク
掲載日 令和3年1月12日
最終更新日 令和3年1月12日


