プレスリリース サリドマイド催奇性を引き起こすタンパク質の発見―サリドマイドによる副作用のメカニズムを提唱―
プレスリリース
愛媛大学
東北大学
名古屋大学
名古屋工業大学
日本医療研究開発機構
背景
サリドマイド1)は半世紀以上前に妊婦における睡眠導入剤として世界中で使用された薬剤ですが、服用した妊婦から生まれた胎児の四肢に重篤な催奇性2)を示したことから、サリドマイド薬禍といわれるほどの世界規模の薬害問題を引き起こしました。その後、ハンセン病や多発性骨髄腫に対する薬効が認められ、現在、サリドマイドやサリドマイド誘導体(レナリドミド及びポマリドミド)は厳格な安全管理のもと、多発性骨髄腫などの血液がんに対する治療薬として年間約1兆円の規模で使用されている非常に有効な薬剤です。サリドマイドやサリドマイド誘導体(Immunomodulatory drug/IMiD3))は、タンパク質分解酵素であるE3ユビキチンリガーゼ4)の構成因子のひとつであるセレブロン(CRBN)へ結合することにより、様々なタンパク質の分解を誘導し、その結果、多様な薬理作用および副作用を示すことが明らかとなっています。
これまでに、胎児の四肢発生に重要な役割を果たすタンパク質SALL4(Sal-like protein 4)が、IMiD依存的にCRBNによって分解誘導されることが報告されていました。また、最近我々はサリドマイドが体内で代謝されて生じる水酸化体(5位水酸化サリドマイド)5)が、サリドマイドよりも効率的にSALL4に作用するメカニズムを構造解析によって明らかにしました(参考文献1)。しかしながら、サリドマイドやサリドマイド誘導体によって引き起こされる催奇性のメカニズムに関しては未解明な点が多く残されており、SALL4以外の原因タンパク質の存在が示唆されていました。
研究成果
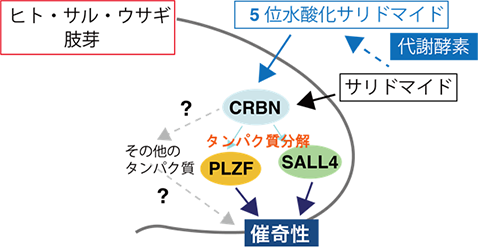
本研究では、サリドマイド催奇性に関わるタンパク質として新たにPLZF(promyelocytic leukemia zinc finger)を見出し、サリドマイド催奇性の分子メカニズムを明らかにしました。コムギ無細胞タンパク質合成系とAlphaScreen法6)を組み合わせることによって、サリドマイド依存的にCRBNと相互作用するタンパク質を検出する方法を構築しました(図1、左)。コムギ無細胞タンパク質合成系によって構築された1,118種類から成るヒトの転写因子プロテインアレイを対象にした網羅的な探索の結果、サリドマイド依存的にCRBNと相互作用するタンパク質としてPLZFを見出しました(図1、右)。また、培養細胞を用いた解析の結果、PLZFはサリドマイドやサリドマイド誘導体、そして5位水酸化サリドマイドによってCRBN依存的に分解されることが明らかとなりました。次に、サリドマイド感受性の動物種であるニワトリ胚を対象にPLZFの遺伝子ノックダウン実験7)を行なった結果、ニワトリ胚の四肢発達においてPLZFは重要な役割を果たすことが示されました(図2、左)。さらに、ニワトリ胚へサリドマイドや5位水酸化サリドマイドを投与することによって、ニワトリ胚の肢芽においてPLZFが減少している一方で、SALL4は減少しないことが確認されました(図2、右)。最後に、ニワトリ胚へPLZFを過剰発現することによって、サリドマイド投与に伴って引き起こされる繊維芽細胞増殖因子のFgf8やFgf10の発現減少が、回復することが明らかとなりました(図3)。今回の発見は、CRBNによるサリドマイド依存的なPLZFの分解がサリドマイド催奇性に直接関与していることを示しており、ヒトやサル、ウサギのようなサリドマイドに対して感受性の高い生物種においてはサリドマイドが体内の代謝酵素により5位水酸化サリドマイドへ代謝されることと、SALL4とPLZFの両方のタンパク質が分解されることによって、重篤な催奇性が引き起こされることを強く示唆しています(図4)。
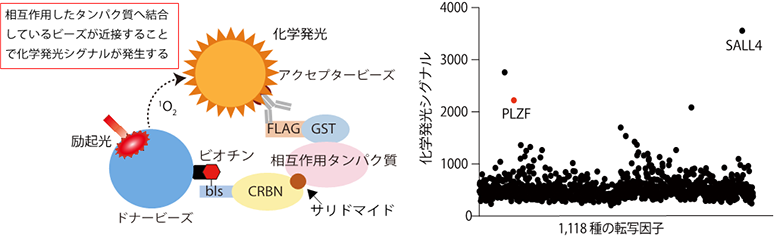
およびヒト転写因子プロテインアレイを用いた網羅的な相互作用解析の結果(右)
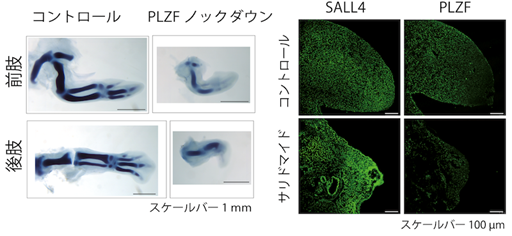
サリドマイド投与によるニワトリ肢芽におけるPLZFの分解(右)
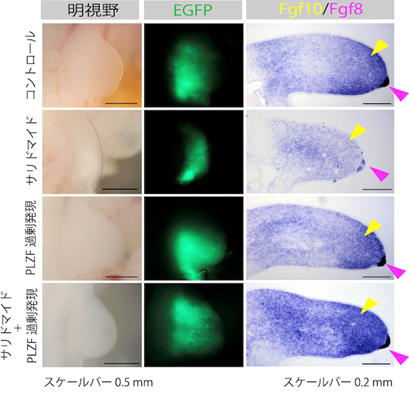
(黄色矢尻;Fgf10の発現領域、ピンク色矢尻;Fgf8の発現領域)
波及効果
サリドマイドやサリドマイド誘導体は、世界中で年間約1兆円の規模で使用されている低分子医薬品であり、標的タンパク質を分解するというその強力な薬効から近年非常に注目を集めています。実際に、様々な疾患を対象に新たなサリドマイド誘導体の開発や臨床研究が活発に行われています。したがって、新たなサリドマイド誘導体の開発を行う上で催奇性を回避することは重要な課題となっています。本研究のサリドマイド催奇性に関与するタンパク質としてのPLZFの発見は、今後のSALL4およびPLZFへの作用を軽減した新たなサリドマイド誘導体を開発する上で重要な位置付けになることが予想されます。
研究体制と支援について
本研究は、愛媛大学プロテオサイエンスセンター、東北大学大学院生命科学研究科、名古屋大学大学院生命農学研究科、名古屋工業大学大学院工学研究科との共同研究として行われました。
また、研究の実施にあたっては、日本学術振興会(JSPS)科学研究費助成事業、新学術領域研究「数理解析に基づく生体シグナル伝達システムの統合的理解」、武田科学振興財団、日本医療研究開発機構(AMED)創薬等ライフサイエンス研究支援基盤事業(BINDS)「コムギ無細胞系による構造解析に適した複合体タンパク質生産・調製技術と低分子抗体作製技術の創出」の支援を受けました。
論文タイトルと著者
- タイトル
- Thalidomide and its metabolite 5-hydroxythalidomide induce teratogenicity via the cereblon neosubstrate PLZF
- (和訳)サリドマイドとその代謝物5位水酸化サリドマイドはCRBNネオ基質PLZFを介して催奇性を引き起こす
- 著者
- 山中聡士(愛媛大学)、村井英隆(東北大学)、斎藤大介(東北大学 現:九州大学)、阿部玄武(東北大学)、徳永恵津子(名古屋工業大学)、岩崎隆宏(愛媛大学)、高橋宏隆(愛媛大学)、竹田浩之(愛媛大学)、鈴木孝幸(名古屋大学)、柴田哲男(名古屋工業大学)、田村宏治(東北大学)、澤崎達也(愛媛大学)
- 掲載誌
- THE EMBO JOURNAL
- Journal link
- https://www.embopress.org/doi/10.15252/embj.2020105375
- 掲載日
- 2021年1月20日(水)
用語説明
- 1)サリドマイド
- 睡眠作用および免疫調整作用を持つ低分子薬剤であり、多発性骨髄腫などの血液がんやハンセン病による2型らい反応に対する治療薬として利用されている。
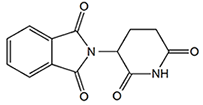
図5.サリドマイドの化学構造 - 2)催奇性
- 薬剤などのある種の物質が生物の正常な発生を阻害して奇形を生じさせる性質や作用のことで、催奇形性と同義で使われる。
- 3)Immunomodulatory drug/IMiD
- サリドマイドやその誘導体の総称であり免疫調整薬とも呼ばれる。イカロスやアイオロスと呼ばれるタンパク質の分解を引き起こし、多発性骨髄腫などの血液がんに対する治療薬として世界中で使用されている。
- 4)E3ユビキチンリガーゼ
- タンパク質のユビキチン化を引き起こす酵素。細胞内でユビキチン化されたタンパク質はプロテアソームによって分解される。
- 5)5位水酸化サリドマイド
- サリドマイドが投与されたヒトやウサギを含む様々な動物種において、代謝酵素CYP450sによって生体内で生成されるサリドマイド代謝物。
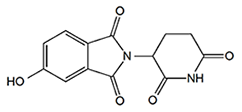
図6.5位水酸化サリドマイドの化学構造 - 6)AlphaScreen法
- PerkinElmer社より販売されている相互作用解析技術。2種類のビーズを用いて各ビーズが結合した2種類のタンパク質が相互作用することにより、2種類のビーズが近接し、化学発光シグナルが得られる。
- 7)遺伝子ノックダウン実験
- 特定の遺伝子のメッセンジャーRNAの量を減少させることによって、標的のタンパク質の発現量を減少させる手法。
- 参考文献1
- Hirotake Furihata, Satoshi Yamanaka, Toshiaki Honda, Yumiko Miyauchi, Atsuko Asano, Norio Shibata, Masaru Tanokura, Tatsuya Sawasaki, Takuya Miyakawa (2020) Structural bases of IMiD selectivity that emerges by 5-hydroxythalidomide Nat Commun 11: 4578
お問い合わせ先
本件に関する問合せ先
愛媛大学プロテオサイエンスセンター
教授 澤崎達也(さわさきたつや)
TEL:089-927-8530
E-mail:sawasaki“AT”ehime-u.ac.jp
東北大学大学院生命科学研究科
教授 田村宏治(たむらこうじ)
TEL:022-795-3489
E-mail:tam“AT”tohoku.ac.jp
名古屋大学大学院生命農学研究科
准教授 鈴木孝幸(すずきたかゆき)
TEL:052-788-6283
E-mail:suzuki.takayuki“AT”j.mbox.nagoya-u.ac.jp
名古屋工業大学大学院工学研究科 共同ナノメディシン科学専攻
教授 柴田哲男(しばたのりお)
TEL:052-735-7543
E-mail:nozshiba“AT”nitech.ac.jp
AMED事業に関するお問い合わせ先
国立研究開発法人日本医療研究開発機構(AMED)
創薬事業部 医薬品研究開発課 創薬等ライフサイエンス研究支援基盤事業(BINDS)
TEL:03-6870-2219 FAX:03-6870-2244
E-mail:20-ddlsg-16“AT”amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
関連リンク
掲載日 令和3年1月20日
最終更新日 令和3年1月20日


