プレスリリース ミトコンドリアの酵素がパーキンソン病原因遺伝子産物Parkinを分解し細胞死を防ぐことを発見―孤発性パーキンソン病の病態メカニズムに新たな概念を提唱―
プレスリリース
学習院大学
東京薬科大学
日本医療研究開発機構
発表者
椎葉一心(学習院大学 理学部 生命科学科 分子生化学 助教/東京薬科大学 生命科学部 分子生化学研究室 大学院生)
武田啓佑(学習院大学 理学部 生命分子科学研究所 客員所員/東京薬科大学 生命科学部 分子生化学研究室 博士研究員)
長島駿(東京薬科大学 生命科学部 分子生化学研究室 助教)
伊藤直樹(学習院大学 理学部 生命分子科学研究所 客員所員/東京薬科大学 生命科学部 分子生化学研究室 大学院生)
藤川雄太(東京薬科大学 生命科学部 分子生物化学研究室 助教)
稲留涼子(学習院大学 理学部 生命科学科 分子生化学 博士研究員)
柳茂(学習院大学 理学部 生命科学科 分子生化学 教授/東京薬科大学 名誉教授)
研究体制
学習院大学 東京薬科大学 東京大学 新潟大学
発表のポイント
- パーキンソン病原因遺伝子産物Parkin(パーキン)が細胞死抑制タンパク質(FKBP38)の分解を促進して細胞死を誘導するメカニズムを解明。
- ミトコンドリアに存在する酵素MITOL(マイトル:Mitochondria Ubiquitin Ligase)がParkinを分解し、細胞死抑制タンパク質(FKBP38)を保護することで細胞死を抑制することを発見。
- ミトコンドリアの酵素の活性化がパーキンソン病などの新たな治療標的になることを示唆。
発表の概要
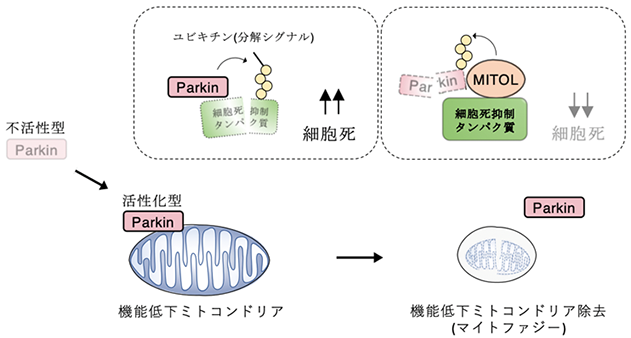
学習院大学椎葉一心助教と柳茂教授らの研究グループは、東京大学、新潟大学、東京薬科大学と共同で、パーキンソン病原因遺伝子産物Parkin1)が細胞死を引き起こすメカニズム、およびミトコンドリアに存在する酵素MITOL2)がParkinを分解することで細胞を保護していることを発見しました。
ミトコンドリアは細胞内のエネルギー産生を担うだけでなく、細胞の生と死の運命を決定する主要な細胞小器官(オルガネラ)です。ミトコンドリアの機能低下は、パーキンソン病3)やアルツハイマー病などの神経変性疾患をはじめとする様々な疾患の原因になることが明らかとなっています。正常な細胞は、損傷や老化により機能が低下したミトコンドリアを選択的に除去する非常に巧妙なシステムを用いて細胞を保護しています。このシステムはマイトファジー4)(オートファジーの一種)と呼ばれ、パーキンソン病原因遺伝子産物として知られているParkinがマイトファジーの調節に重要な役割を果たしていると言われています。そのため、Parkinの機能欠失により、機能低下したミトコンドリアが蓄積し、パーキンソン病の発症につながっているのではないかと考えられています。
一方で、近年、マイトファジーの進行途中でParkinが細胞死を誘導することや孤発性パーキンソン病患者脳において活性化したParkinが蓄積していることが明らかになりました。このことから、Parkinは機能欠失のみならず過剰な活性化によってもパーキンソン病を引き起こす可能性が考えられます。しかし、Parkinがどのように細胞死を引き起こしているのか、またParkinによる細胞を保護する機能と細胞死を誘導する機能の相反する二つの機能がどのように調節されているのかは不明でした。
先行研究において、マイトファジーの進行時に細胞死が起こらないよう、細胞死抑制タンパク質であるFKBP385)が機能低下したミトコンドリアから脱出し、他のオルガネラである小胞体へ移行することが報告されていました。本研究グループは、今回の研究によって、同グループが以前に見いだしたミトコンドリアに存在する酵素MITOLの機能に異常がある場合、マイトファジーの際にParkinが小胞体上でFKBP38を分解し細胞死を引き起こすことを明らかにしました。一方で、MITOLが正常に機能している場合は、Parkinにより機能低下したミトコンドリアの除去を妨げないよう、MITOLがParkinを分解しFKBP38を保護していることを見出しました(図)。これらの結果から、MITOLはFKBP38を保護することによりParkinによる細胞死を誘導する機能と細胞を保護する機能の相反する機能を制御していることがわかりました。これらの新たなメカニズムの解明は、パーキンソン病やマイトファジーが関連する疾患に対し、MITOLの活性化を標的とした新しい概念による治療戦略に繋がる可能性が期待されます。
本成果は、欧州科学雑誌「EMBO reports」に掲載されます。
本研究は、日本医療研究開発機構(AMED)「老化メカニズムの解明・制御プロジェクト」、文部科学省科学研究費補助金および私立大学戦略的研究基盤形成支援事業の支援を受けて行われました。
発表内容
研究の背景と経緯
パーキンソン病は中脳黒質のドーパミン作動性ニューロンの変性を主因とした神経変性疾患の一つです。1980年代に、パーキンソン病患者脳でミトコンドリア機能の低下が確認されたことを契機にミトコンドリアを中心としたパーキンソン病の発症メカニズムの解明が進められてきました。その中で、2008年にパーキンソン病原因遺伝子産物Parkinが、損傷または老化したミトコンドリアを選択的に除去するシステム(マイトファジー)に関連することが報告されました。この報告をきっかけに、パーキンソン病の発症原因の一つは「Parkinの機能不全による不良ミトコンドリアの蓄積」が要因であるという仮説が世界中で支持されるようになりました。しかし、Parkinの細胞保護的な側面が支持される一方で、近年、マイトファジーの際にParkinが細胞死を誘導することが報告されました。しかし、Parkinがどのように細胞死を引き起こしているのか、またParkinが引き起こす細胞死を抑制する機構の存在などは詳しくわかっていませんでした。
研究の内容
本研究グループは、これまでミトコンドリア外膜に存在する酵素MITOL(Mitochondrial Ubiquitin Ligase)を同定し、MITOLがユビキチンと呼ばれる分解シグナルを用いることで、細胞毒性をもつ不溶性タンパク質を除去し、ミトコンドリアの品質を管理していることを明らかにしてきました。
本研究では、マイトファジーにおけるParkinの細胞死誘導機構とMITOLによる細胞保護機構に焦点を当て解析を進めました。
まず、マイトファジーの中心因子であるParkinと結合する候補タンパク質の網羅的解析において、ParkinとMITOLが結合していることがわかりましたこの結合はマイトファジーの誘導時に特異的に観察されたため、MITOLはマイトファジーにおいて、Parkinを制御しているのではないかと考え、解析をした結果、MITOLはマイトファジーに応答してParkinへユビキチンを付加し分解を誘導することがわかりました(図1)。
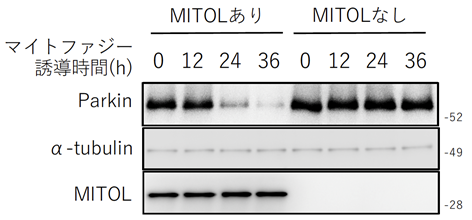
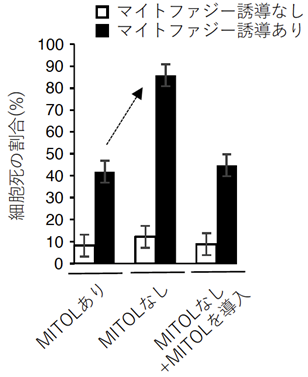
次にMITOLがParkinを分解する生理的意義を解明するために、MITOLを欠失した細胞にマイトファジーを誘導したところ、Parkinの過剰な蓄積と細胞死の亢進が認められました(図2上、図3)。このことから、過剰なParkinの蓄積が細胞を傷害しているのではないかと考えました。また、MITOLを欠失した細胞にマイトファジーを誘導するとParkinの蓄積と共に、細胞死抑制タンパク質であるFKBP38のタンパク量が減少することがわかりました(図2下)。そこで、ParkinとFKBP38の関係について解析したところ、MITOLを欠失した条件下では、Parkinはマイトファジーの際にFKBP38の分解を促進して細胞死が誘導され、MITOL存在下では、Parkinを分解することによってFKBP38を保護していることが明らかになりました。
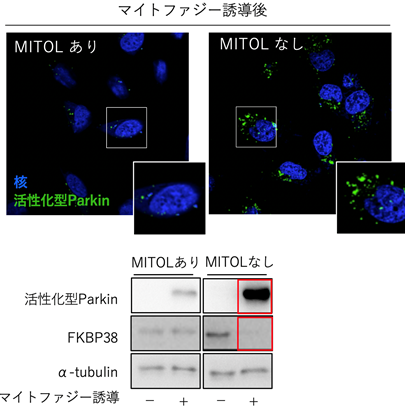
さらに、先行研究により、FKBP38がミトコンドリアから小胞体へ移動することが報告されていたことから、MITOLもFKBP38と同様に小胞体へ移動しているのではないかと考えました。この仮説を検証した結果、MITOLはFKBP38に依存して一緒にミトコンドリアから小胞体へ移動する様子が観察され、マイトファジーの過程でMITOLが徐々に他のオルガネラへ移動し、MITOLがFKBP38の保護機構に重要な役割を果たしていることを見いだしました(図4)。
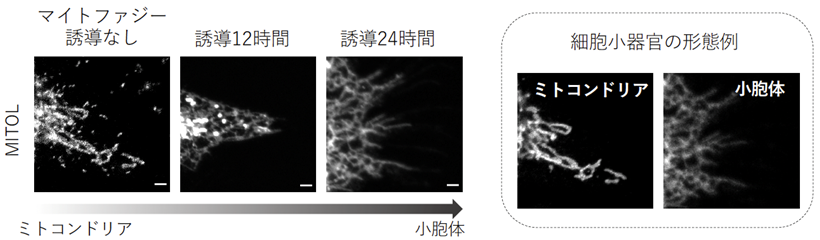
これらの結果により、Parkinの細胞死を制御するメカニズムにおいて、MITOLがParkinを分解することでFKBP38を保護し、細胞死を制御していることが明らかになりました。また、MITOLはこれまでミトコンドリア外膜上で種々の応答を行っていると考えられていましたが、他のオルガネラに移動して細胞機能を調節していることが明らかになりました。外膜を4回貫通するMITOLがどのようにしてミトコンドリアから小胞体に移動するのかについては今のところ不明ですが、オルガネラ間のMITOLの密接な連携が細胞機能の調節に重要な役割を果たすことが示されました。
今後の展望
本研究成果により、ミトコンドリアの酵素であるMITOLがParkinの分解を誘導することにより細胞死を抑制することが明らかとなり、Parkinによる細胞生存と細胞死の相反する機能の制御機構が解明されました。原因遺伝子は正常な遺伝子に変異が入ることで、病態発症の原因になると考えられています。Parkinはパーキンソン病の原因遺伝子産物であり従来は、Parkinに変異が入ることでパーキンソン病が発症するのではないかと考えられていました。しかし今回、老化に伴い、正常なParkinが適切に制御を受けることができなくなると、孤発性(加齢性)パーキンソン病の原因となる可能性が示されました。今回得られた新たな機構解明により、孤発性パーキンソン病の病態解明に貢献すると共にMITOLの活性化を標的としたパーキンソン病の新たな概念による治療戦略に繋がることが期待されます。
発表雑誌
- 著者
- Isshin Shiiba, Keisuke Takeda, Shun Nagashima, Naoki Ito, Takeshi Tokuyama, Shun-ichi Yamashita, Tomotake Kanki, Toru Komatsu, Yasuteru Urano, Yuuta Fujikawa, Ryoko Inatome, and Shigeru Yanagi
- 椎葉一心、武田啓佑、長島駿、伊藤直樹、徳山剛士、山下俊一、神吉智丈、小松徹、浦野泰照、藤川雄太、稲留涼子、柳茂
- 論文タイトル
- MITOL promotes cell survival by degrading Parkin during mitophagy
- マイトファジーにおいてMITOLはParkinを分解することで細胞保護的に働く
- 雑誌名
- EMBO reports
- 掲載日
- 2021年2月10日 日本時間/JST20時00分(中央ヨーロッパ時間/CET2021年2月10日12時00分)
- DOI
- 10.15252/embr.201949097
- 論文URL
- https://www.embopress.org/doi/10.15252/embr.201949097
研究支援
日本医療研究開発機構(AMED)「老化メカニズムの解明・制御プロジェクト」、文部科学省科学研究費補助金および私立大学戦略的研究基盤形成支援事業
用語解説
- 1)Parkin
- パーキンソン病原因遺伝子産物であり、通常は細胞質に局在する酵素。機能低下したミトコンドリアに集まる特性を持つ。MITOLと同様にユビキチンリガーゼ活性を有している。
- 2)MITOL(Mitochondria Ubiquitin Ligase)
- ミトコンドリア外膜に局在する酵素。ユビキチンリガーゼ活性を有し、近傍のタンパク質にユビキチンを付加することでタンパク質の分解を誘導し、細胞内の品質管理を担っている。
- 3)パーキンソン病
- 中脳黒質のドーパミン神経が減少することで神経伝達物質であるドーパミンの放出量が低下し、手の震え、筋肉がこわばる、動作が緩慢になる、歩行障害などの症状を示す進行性の神経変性疾患。孤発性(加齢性)と遺伝性に大別され、遺伝性については原因遺伝子の存在がいくつか明らかとなっている。近年ミトコンドリアの機能低下が病態発症に関係することがわかった。
- 4)マイトファジー
- 2016年のノーベル生理学・医学賞の受賞対象となった細胞内システムであるオートファジーの一種。オートファジーを用いて機能低下したミトコンドリアのみを選択的に除去する機構で、近年パーキンソン病原因遺伝子産物Parkinによって制御されることがわかった。
- 5)FKBP38
- ミトコンドリアに局在し、細胞死抑制タンパク質と結合し細胞死を抑制している。マイトファジーの際に、細胞死抑制タンパク質と共にミトコンドリアから小胞体へ移動することがわかっている。
お問い合わせ先
研究に関すること
学習院大学 理学部 生命科学科 分子生化学
教授 柳茂(やなぎしげる)
TEL:03-5992-1262
E-mail:shigeru.yanagi“AT”gakushuin.ac.jp
学習院大学 理学部 生命科学科 分子生化学研究室
助教 椎葉一心(しいばいっしん)
TEL:03-5904-9424
E-mail:isshin.shiiba“AT”gakushuin.ac.jp
取材に関すること
学習院大学 学長室 広報センター(担当 湯元)
東京都豊島区目白1-5-1
TEL:03-5992-1008
E-mail:koho-off“AT”gakushuin.ac.jp
東京薬科大学 総務部 広報課
東京都八王子市堀之内1432-1
TEL:042-676-6711
E-mail:kouhouka“AT”toyaku.ac.jp
AMEDの事業に関すること
日本医療研究開発機構(AMED)
疾患基礎研究事業部 疾患基礎研究課
TEL:03-6870-2286 FAX:03-6870-2243
老化メカニズムの解明・制御プロジェクト
E-mail:aging“AT”amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
関連リンク
掲載日 令和3年2月10日
最終更新日 令和3年2月10日


