プレスリリース 腸内細菌のD-アミノ酸が粘膜免疫を制御する仕組みを解明
プレスリリース
慶應義塾大学医学部
実験動物中央研究所
日本医療研究開発機構
慶應義塾大学医学部薬理学教室の鈴木将貴特任助教、笹部潤平専任講師、安井正人教授らの研究グループは、同内科学(消化器)教室の金井隆典教授、米国ハーバード大学メディカルスクールのMatthew Waldor教授、公益財団法人実験動物中央研究所の伊藤守所長、九州大学大学院薬学研究院の浜瀬健司教授らとの共同研究にて、腸内細菌由来のD-アミノ酸(注1)の代謝が宿主の腸管免疫を制御していることを発見しました。
哺乳類の消化管に生息する腸内細菌は様々な代謝物を作っています。我々ヒトを含めた哺乳類は、このような細菌の代謝物や断片構造を認識し、適度な免疫反応を起こしながら、細菌とうまくバランスをとって共生しています。興味深いことに、細菌は哺乳類がつくることができない代謝物であるD-アミノ酸を利用して、自身の外壁となる構造を作り上げています。しかし、この細菌に特徴的なD-アミノ酸が哺乳類の免疫にどう影響を与えるのか、さらに哺乳類と細菌との共生関係にどのような意味があるのか分かっていませんでした。
今回、研究グループはD-アミノ酸だけを認識して分解する哺乳類の酵素が、免疫グロブリンA(IgA、注2)の量と質を制御して、細菌との共生を調節していることを発見しました。
IgAは粘膜バリアを形成する主要な免疫グロブリンで、腸内細菌との共生関係を調節し、病原性細菌やウイルスの感染から生体を守る役割を持っています。哺乳類のD-アミノ酸代謝酵素が機能を失うと、腸内フローラに乱れが生じるとともに、D-アミノ酸が増加します。これに反応して、免疫を担当するマクロファージとBリンパ球が活性化してIgAの産生を増やし、腸内フローラに対して過剰に反応してしまうことがわかりました。つまり、宿主であるヒトは腸内細菌の合成するD-アミノ酸を認識することで免疫を調節し、細菌との共生関係を維持していることがわかりました。ヒトと細菌との共生関係の乱れは、免疫・代謝・神経系など様々な疾患に関与することが明らかになりつつあり、本研究が発展することで、共生細菌の乱れが引き起こす病気の理解や新しい治療標的の開発につながることが期待されます。
本研究成果は、2021年3月3日(米国東部時間)に国際総合学術誌である『Science Advances』(オンライン版)に掲載されました。
研究の背景と概要
アミノ酸にはL型とD型が存在します。L型とD型は、構成は同じですが、お互いに鏡像の関係で重なり合うことはありません。不思議なことに、生物が作るタンパク質は基本的にL-アミノ酸のみで作られています。哺乳類をはじめとする真核生物は、多様なL-アミノ酸を体の中で合成したり食べ物から摂取したりして利用していますが、ほとんどのD-アミノ酸を合成することはできません(注1)。一方で細菌は例外的にD-アミノ酸を合成することができる生物で、それらを自らの細胞壁の合成や細菌同士のコミュニケーションの手段として利用して進化してきました(図1)。一部の抗生物質は、細菌のD-アミノ酸を含む構造を標的にすることで殺菌作用を発揮することが知られており、まさにD-アミノ酸は細菌特有の代謝物ともいえます。哺乳類の消化管には、宿主の細胞を遥かに超える数の腸内細菌が存在し、それらが作る代謝物や断片構造は、宿主の正常な生理機能に不可欠な存在であることが近年明らかになってきました。しかしながら、腸内細菌が合成するD-アミノ酸が宿主の生理機能に与える影響は明らかになっていませんでした。
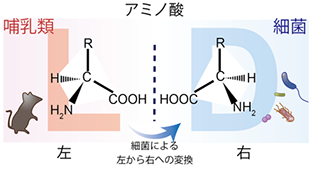
研究の成果と意義・今後の展開
研究グループは、哺乳類のD-アミノ酸酸化酵素(DAO)が多様なD-アミノ酸を認識して分解することに着目しました。先の研究で、DAOは腸内細菌によって小腸に発現誘導され、腸内細菌が作るD-アミノ酸量を調節していることを明らかにしました(参考文献)。
DAOの活性を欠損したマウス(DAO変異マウス)は、細菌に由来するD-アミノ酸が体内で野生型の10倍量にまで蓄積します。このマウスでは、小腸の形質細胞(注3)が増え、IgAを5倍以上産生していることを発見しました。一方、このマウスに抗生物質を投与して腸内細菌を減らすと、IgAの増加が認められなくなることから、DAOはD-アミノ酸調節のみならず、腸内細菌が誘導するIgAの産生にも関わっていることがわかりました(図2(a))。
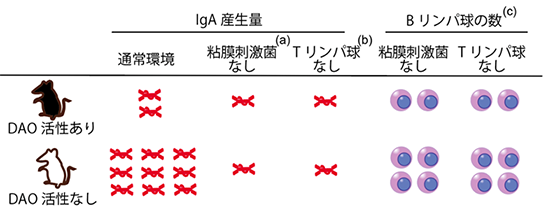
IgAを産生する形質細胞は、もともとBリンパ球が成熟してできた細胞です。この成熟過程にはTリンパ球が関与する経路と関与しない経路があることが知られています。そこで、T細胞受容体が欠損したDAO変異マウスを実験動物中央研究所にて作成し、Tリンパ球からの刺激を人為的に消したところ、IgAの増加はほとんど認められなくなりました。つまり、DAOが調節するIgA産生には、Tリンパ球の刺激が不可欠であることがわかりました(図2(b))。さらに、DAO変異マウスでは、小腸に放出されたIgAはセグメント細菌などの粘膜接着性や運動性の高い菌(粘膜刺激菌)を多く認識していることがわかり、DAOは粘膜刺激性のある細菌群を調節することでTリンパ球の過剰な刺激を抑えていると考えられます。
一方で、DAO変異マウスでは、Tリンパ球が関与しない別の経路もIgA産生に関与しています。粘膜刺激性の低い腸内細菌を持つDAO変異マウスでは、Tリンパ球が刺激されないためIgA産生は変化しませんでした。しかし、興味深いことに、形質細胞になる前段階のBリンパ球は、Tリンパ球刺激の有無に関わらず増加していました(図2(c))。そこで、これらのマウスの小腸粘膜の上皮組織の遺伝子発現を解析したところ、炎症性サイトカイン(注4、TNFα、IL1β、IFNγなど)を含め、免疫応答に関わる遺伝子の発現が有意に増加していることがわかりました。さらに培養したマクロファージの細胞を用いた実験で、細菌がつくるD-アラニンがマクロファージを直接刺激し、炎症性サイトカインの産生を増加させる結果、Bリンパ球数を増やすことを発見しました。
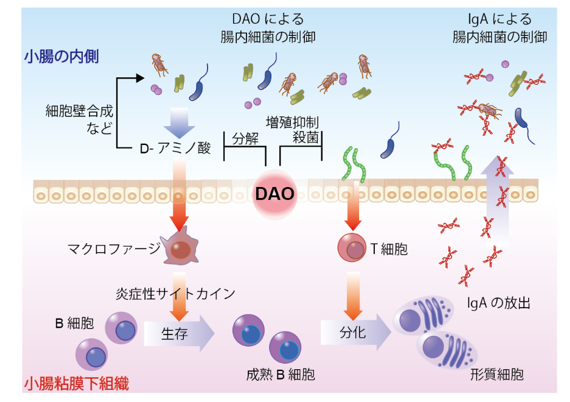
つまり、マクロファージは、D-アラニンを細菌による刺激と認識し、Bリンパ球を増やす指令を出します。そこへ粘膜刺激性の高い細菌群がTリンパ球を刺激することで、Bリンパ球が形質細胞へ分化するのが促進され、IgAが産生されると考えられます(図3)。DAOは(1)D-アミノ酸を分解すること、(2)粘膜刺激性の細菌を制御すること、の2つの方法でBリンパ球の過剰な反応を抑え、腸内細菌との共生のバランスを保つ働きをしています。このような共生のバランスが乱れると、免疫・アレルギー性疾患や代謝性疾患、神経疾患などさまざまな病気の悪化に影響を及ぼすことが、近年徐々に明らかになってきています。本研究を通して、D-アミノ酸の調節が、細菌との共生のバランス維持に大切であることが新たにわかりました。今後はL-/D-アミノ酸調節を標的にして、上記の様々な病気の機序の解明や新しい治療法開発につながることが期待されます。
特記事項
本研究は国立研究開発法人日本医療研究開発機構(AMED)の革新的先端研究開発支援事業(PRIME)「微生物叢と宿主の相互作用・共生の理解と、それに基づく疾患発祥のメカニズム解明」領域における研究開発課題「D-アミノ酸を介した細菌叢-宿主相互作用による粘膜免疫構築機構と免疫疾患における病態生理学的意義の解明」、JSPS科研費JP16K09327・JP18K07181、一般財団法人守谷育英会研究助成および坂口光洋記念慶應義塾医学振興基金医学研究助成事業の支援によって行われました。
また、アミノ酸分析はKAGAMI株式会社の技術支援のもと行いました。
論文
- 英文タイトル
- Host-microbe crosstalk governs amino acid chirality to regulate survival and differentiation of B cells
- タイトル和訳
- 宿主-腸内細菌相互作用はアミノ酸のキラリティを決定することでB細胞の生存と分化を制御する
- 著者名
- 鈴木将貴、筋野智久、千葉明子、原田洋輔、後藤元人、高橋利一、三田真史、濱瀬健司、金井隆典、伊藤守、Matthew K Waldor、安井正人、笹部潤平
- 掲載誌
- Science Advances(オンライン版)
- DOI
- 10.1126/sciadv.abd6480
用語解説
- (注1)D-アミノ酸
- 右手と左手のように鏡像関係にあるものの、互いに重なり合わない性質をキラリティと呼ぶ。アミノ酸にはキラリティがあり、左手・右手の関係にあるL型・D型(L-アミノ酸、D-アミノ酸)がある。このうち、ヒトも含めたほとんどの生き物はL型のみを利用している。D-セリンなど例外的に特定の真核生物で合成されるものもある。D-アラニンは細菌が特徴的に合成し、細菌細胞壁の材料として不可欠である。
- (注2)IgA
- 粘膜において細菌やウイルスを補足し、宿主への侵入を抑える抗体の一種。感染のない状況でも恒常的に産生され、いろいろな菌に緩く結合する型と、特定の菌やウイルスに特異的かつ強力に結合する型が存在する。過剰産生によりIgA腎症などの自己免疫疾患の原因にもなりうる。
- (注3)形質細胞
- 免疫を担当するB細胞が細菌などを補足したマクロファージなどの抗原提示細胞から刺激を受けることで分化し、免疫グロブリンを放出できるようになった細胞。
- (注4)炎症性サイトカイン
- 細菌感染などを受けて産生され、さまざまな免疫細胞を感染部位に呼び込んだり、細菌に対する攻撃因子の産生を促したりする分子。感染に抵抗するための重要な分子であり、これらを抑制すると感染症にかかりやすくなることが知られている。一方で、過剰に働くと組織障害を引き起こし、炎症性疾患を誘導してしまう場合があるため注意が必要。
参考文献
- タイトル
- Interplay between microbial d-amino acids and host d-amino acid oxidase modifies murine mucosal defence and gut microbiota
- 掲載誌
- Nature microbiology
- DOI
- 10.1038/nmicrobiol.2016.125
本発表資料のお問い合わせ先
慶應義塾大学医学部 薬理学教室
専任講師 笹部潤平(ささべじゅんぺい)
TEL:03-5363-3750 FAX:03-3359-8889
E-mail:sasabe“AT”keio.jp
The Chiral Biology Research Group
本リリースの配信元
慶應義塾大学信濃町キャンパス総務課:山崎・飯塚
(〒160-8582 東京都新宿区信濃町35)
TEL:03-5363-3611 FAX:03-5363-3612
E-mail:med-koho“AT”adst.keio.ac.jp
慶應義塾大学医学部・医学研究科
公益財団法人実験動物中央研究所 広報室
(〒210-0821 神奈川県川崎市川崎区殿町3-25-12)
TEL:044-201-8516 FAX:044-201-8511
E-mail:pr-office“AT”ciea.or.jp
CIEA|公益財団法人実験動物中央研究所|Central Institute for Experimental Animals
AMED事業に関するお問い合わせ先
国立研究開発法人日本医療研究開発機構(AMED)
シーズ開発・研究基盤事業部 革新的先端研究開発課
(〒100-0004 東京都千代田区大手町1-7-1 読売新聞ビル21階)
TEL:03-6870-2224 FAX:03-6870-2246
E-mail:kenkyuk-ask“AT”amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
関連リンク
掲載日 令和3年3月4日
最終更新日 令和3年3月4日


