プレスリリース B型肝炎ウイルスを簡便で迅速かつ高感度に検出する「高感度抗原定量検査法」を開発―B型肝炎ウイルス再活性化モニタリング検査への導入に期待―
プレスリリース
熊本大学
名古屋市立大学
日本医療研究開発機構
研究のポイント
- B型肝炎ウイルス(HBV)を検出する新しい検査法「高感度HBコア関連抗原定量検査法」を開発しました。
- 同検査法は、従来のPCR法(HBV DNA定量法)よりも「安価」「簡便」で迅速検査(診療前検査)に対応可能で、臨床現場への導入が容易になります。また、従来の抗原検査法と比べて感度(注1)、特異度(注2)、再現性に優れており、特にHBV再活性化(注3)のモニタリング検査で有用性が高い結果となることを証明しました。
- 同検査法によりHBコア関連抗原(HBcrAg)を調べることで、それに相関する肝細胞内の完全閉環二本鎖DNA(covalently closed circular DNA:cccDNA)の量や転写活性の指標とすることができ、病態進行の予測に有効であると考えられます。
概要説明
熊本大学大学院生命科学研究部の田中靖人教授と名古屋市立大学大学院医学研究科の井上貴子講師は、株式会社先端生命科学研究所、富士レビオ株式会社との共同研究の成果として、B型肝炎ウイルス(HBV)を検出する「高感度HBcrAg定量検査法」を新たに開発しました。特に、同検査法はHBV再活性化モニタリング検査でPCR法(HBV DNA定量法)と同等あるいはそれ以上に有用性が高いことを世界で初めて証明しました。これらの結果は臨床現場での新しい検査法の導入に加え、新薬の開発に道を開く可能性を示しています。本研究の成果は令和3年3月22日午前0時(日本時間)に欧州肝臓学会誌「Journal of Hepatology(ジャーナル・オブ・ヘパトロジー)」電子版に公開されます。
説明
背景
B型肝炎ウイルス(HBV)はヒトの肝細胞の核内で完全閉環二本鎖DNA(covalently closed circular DNA:cccDNA)として存在し完全に取り除くことは困難であり、ウイルスの鋳型として残り続けます(図1)。肝細胞内のcccDNA量とその転写活性は、肝硬変・肝癌への進行を予測するうえで重要な要素と考えられています。HBVの感染や治療の効果を測るHBVマーカー(抗原や抗体)には様々な種類があり、その一つである血清HBコア関連抗原(HBcrAg)は、肝細胞内cccDNA量や血中HBV DNA濃度と相関しています。HBcrAgには3種類の抗原[HBc抗原(HBcAg)・22KDaプレコアタンパク(p22cr)・HBe抗原(HBeAg)]が含まれます。
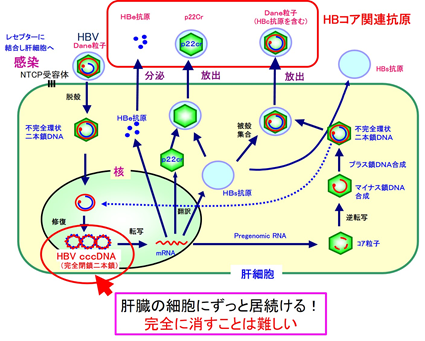
B型慢性肝炎の治療では機能的治癒(注4)を目指し、HBVが体内にあることを示すHBs抗原の消失、さらにはウイルスの鋳型であるcccDNAの低下を目標とします。B型肝炎治療薬である核酸アナログ製剤はHBV DNAの複製を著しく阻害するため、治療中は血液中のHBV DNAの変動をとらえることが難しくなります。一方、HBcrAgは肝細胞内cccDNA量や転写活性(ウイルスの製造状況)を反映しているので、治療中のB型慢性肝炎患者のモニタリングに有用なマーカーです。日本のB型肝炎キャリアの大規模コホート研究の結果から、高濃度(2.9Log U/mL以上)の血清HBcrAgは肝癌発生の独立した危険因子であることが判明しました。ただし、HBcrAgを構成する抗原のうち、HBeAgが陰性の例では従来法では検出できない症例が多く、高感度のHBcrAg測定法の開発が望まれてきました。
研究の成果
①高感度HBcrAg定量検査法の改良点
新たに開発した「高感度HBcrAg定量検査法」では、検体前処理工程の改良検討を重ね、人の手に頼らない(用手法ではない)検査の全自動化を可能とし、処理にかかる時間を短縮しました。また、コア関連抗原に対する血中抗体の不活化と同時に、3種類の異なる構造を持つコア関連抗原をより均質化し同時に測定できるようにしたことで、反応性向上と共にバックグラウンド反応(注5)も低下し、高い感度と特異度を実現しました(表1)。
| HBcrAg測定法 | 検体量 | 検体前処理法 | 検体前処理 を含む測定時間 |
感度(LOQ) |
|---|---|---|---|---|
| 従来法 | 150μL | 用手法 60°Cで30分間 |
60分以上 | 2.8Log U/mL* |
| 高感度HBcrAg定量検査法 | 30μL | 全自動システム 37°Cで6.5分間 |
35分 | 2.1Log U/mL |
*本論文で定量可能な感度(LOQ)検定し、2.8Log U/mLに設定
②高感度HBcrAg定量検査法の基礎性能検討
高感度HBcrAg定量検査法と従来法の比較を行ったところ、HBs抗原陰性血清491検体を用いて、高感度HBcrAg定量検査法のカットオフ値(注6)を2.1Log U/mLに設定した場合、特異度は100%(491/491)、感度は従来法より約10倍向上しました。
③HBV再活性化症例に関する検討
HBVでは、いったんウイルスの増殖が抑えられても、ウイルスの鋳型であるcccDNAを完全に取り除くことは難しいため再活性する場合があります。全身化学療法や免疫抑制療法を始める前の検査で、再活性化のマーカーであるHBc抗体またはHBs抗体が陽性と判定され、HBV再活性化モニタリングの対象となった症例を抽出し、HBV再活性化と診断された13例(血液悪性腫瘍10例、固形癌・良性血液疾患・自己免疫疾患各1例)の検査を行ったところ、69%(9/13)がPCR法(HBV DNA定量法)よりも早期に高感度HBcrAg定量検査法で陽性と判定されました(図2)。一方、全身化学療法や免疫抑制療法によりHBV再活性化を起こさなかった症例55例では、陽性と判定された症例はありませんでした。
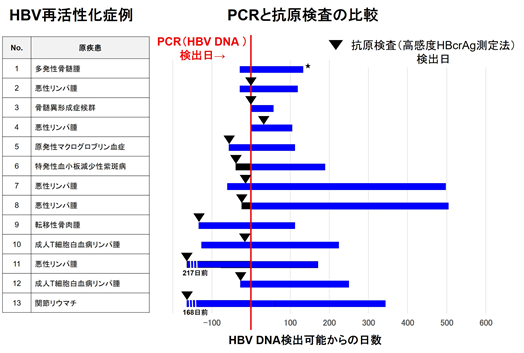
②PCR法と同時あるいは直後に検出 3/13例(23%)
★残り1例はHBV DNA感度未満シグナル陽性例であり、臨床的な意義は不明
④B型慢性肝炎症例に関する検討
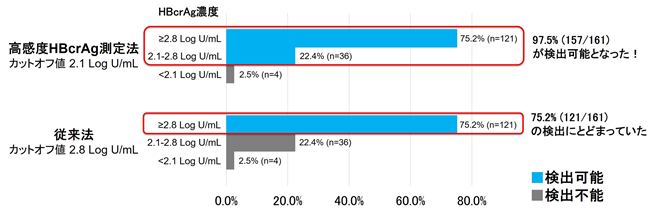
cccDNAが低濃度であると予想されるHBe抗原陰性B型慢性肝炎症例のうち、HBV DNA持続陰性161症例の血清HBcrAgを、高感度HBcrAg定量検査法および従来法で測定しました。161症例中、従来法では75.2%(121/161)、高感度HBcrAg定量検査法では97.5%(157/161)の症例でHBcrAgが検出されました。すなわち、HBcrAg濃度が2.1-2.8Log U/mLである22.4%(36/161)の症例は従来法では検出できず、高感度HBcrAg定量検査法でのみ検出可能でした(図3)。
研究の意義と今後の展開や社会的意義など
本研究により、今回新たに開発した高感度HBcrAg定量検査法の基礎性能は優れており、高感度かつ高い特異性を備えていることが分かりました。全自動化により迅速測定が可能であり、外来通院中のB型慢性肝炎症例の核酸アナログ製剤治療効果判定に活用されることが期待できます。また、HBV再活性化のモニタリングにおいて、高感度HBcrAg定量検査法は血中HBV DNAの代わりとなりうるHBVマーカーとして、今後さらに臨床データの蓄積が望まれます。
用語解説
- (注1)感度
- 検査の性格を決める指標の1つで、ある検査について「陽性と判定されるべきものを正しく陽性と判定する確率」として定義される値。
- (注2)特異度
- 検査の性格を決める指標の1つで、ある検査について「陰性と判定されるべきものを正しく陰性と判定する確率」として定義される値。
- (注3)HBV再活性化
- HBV既往感染患者において、全身化学療法や免疫抑制療法などによりHBVが再増殖すること。HBV再活性化による肝炎は重症化しやすいだけでなく、肝炎の発症により原疾患の治療を困難にするため、発症そのものを阻止することが最重要である。
- (注4)機能的治癒(functional cure)
- ウイルスを体内から完全には除去できなくても、核酸アナログ製剤などの治療を中断した際にウイルスの増殖が起こらない状態のこと。B型肝炎創薬研究の目標ともなっている。
- (注5)バックグラウンド反応
- 血液の成分などによって引き起こされる高い非特異的反応のこと。
- (注6)カットオフ値
- 検査の陽性、陰性を分ける値のこと。その検査結果によって、ある疾患にかかっている人とかかっていない人を分ける境界値。
研究助成
本研究はJSPS科学研究費基盤研究B(JP19H03640)の助成を受け、日本医療研究開発機構(AMED)肝炎等克服実用化研究事業「実用化に向けたB型肝炎新規治療薬の探索及び最適化」の支援により行われました。
論文情報
- 論文タイトル
- Clinical efficacy of a novel, high-sensitivity HBcrAg assay in the management of chronic hepatitis B and HBV reactivation
- (B型慢性肝炎およびHBV再活性化のマネージメントにおける新規「高感度HBcrAg測定法」の臨床的有用性)
- 著者
- 井上貴子1、楠本茂1、飯尾悦子1、小川慎太郎1、鈴木孝典1、八木慎太郎2、金子敦3、松浦健太郎1、青柳克己2、3、田中靖人1、4*(*はcorresponding author)
所属 名古屋市立大学1、先端生命科学研究所2、富士レビオ株式会社3、熊本大学4 - 掲載学術誌
- 学術誌名 Journal of Hepatology
- DOI番号 10.1016/j.jhep.2021.02.017
お問い合わせ先
研究に関するお問い合わせ先
熊本大学大学院生命科学研究部
教授 田中靖人
TEL:096-373-5146 FAX:096-371-0582
E-mail:ytanaka“AT”kumamoto-u.ac.jp
名古屋市立大学大学院医学研究科
講師 井上貴子
TEL:052-853-8191 FAX:052-853-8192
E-mail:clinoue“AT”med.nagoya-cu.ac.jp
報道に関するお問い合わせ
熊本大学 総務部総務課広報戦略室
TEL:096-342-3271 FAX:096-342-3110
E-mail:sos-koho“AT”jimu.kumamoto-u.ac.jp
名古屋市立大学 医学・病院管理部経営課経営係
TEL:052-858-7114 FAX:052-858-7537
E-mail:hpkouhou“AT”sec.nagoya-cu.ac.jp
AMEDの事業に関するお問い合わせ
国立研究開発法人日本医療研究開発機構(AMED)
創薬事業部 創薬企画・評価課
TEL:03-6870-2225 FAX:03-6870-2243
E-mail:hepatitis“AT”amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
関連リンク
掲載日 令和3年3月22日
最終更新日 令和3年3月22日


