プレスリリース ヒトのナイーブ型iPS細胞から胎盤細胞を作る―体外での胎盤発生モデルの構築に成功―
プレスリリース
京都大学iPS細胞研究所(CiRA)
日本医療研究開発機構(AMED)
ポイント
- ヒトのナイーブ型注1)iPS細胞から初めて栄養外胚葉(TE)注2)の作製に成功し、さらにその先の胎盤細胞へ続く細胞群への分化も確認できた。
- 技術的にも倫理的にも難しかったヒトの初期胚の研究において、体外で胎盤細胞の分化過程を模倣するモデルが構築出来た。着床前後の胎盤細胞の変化を調べることが可能となる。
- 次世代iPS細胞として期待されるナイーブ型iPS細胞の初期分化系譜の一端を明らかにした。
要旨
現在、再生医療用iPS細胞ストック・プロジェクト注3)や自家移植による臨床研究が進められていますが、用いられているiPS細胞はプライム型注4)に分類され、品質評価されているものの、株間の差や分化指向性が指摘されています。このような問題を克服する鍵として、受精卵により類似した性質を持つナイーブ型iPS細胞が期待されています。
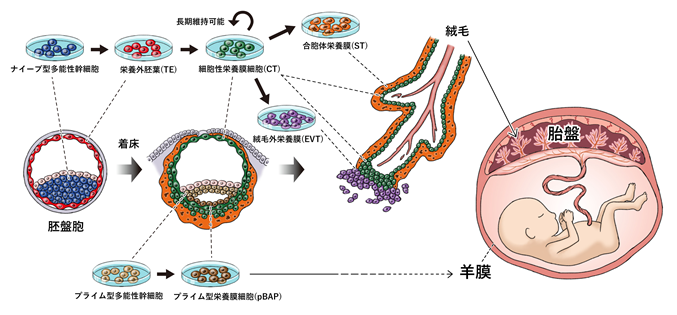
プライム型iPS細胞やES細胞では難しいとされる胎盤細胞への分化もナイーブ型では可能だと考えられていますが、これまでiPS細胞やES細胞等のナイーブ型多能性幹細胞から胎盤細胞の出発点にあたる栄養外胚葉(TE)の作製に成功した報告はなく、体外での胎盤細胞の発生モデルは確立されていませんでした。今回、伊尾紳吾大学院生(CiRA未来生命科学開拓部門、京都大学大学院医学研究科婦人科学産科学)、蒲田未央特定職員(CiRA同部門)、斎藤通紀教授(CiRA同部門、京都大学高等研究院ASHBi)、山本拓也准教授(CiRA同部門、同ASHBi)、万代昌紀教授(同婦人科学産科学)、高島康弘講師(CiRA同部門)らの研究グループは、ナイーブ型のヒトiPS細胞を用いて、TEを作製することに初めて成功しました。さらに、TEから長期保存が可能な細胞性栄養膜細胞(CT) 注5)を作製し、CTから胎盤を構成する合胞体栄養膜細胞(ST) 注6)と絨毛外栄養膜細胞(EVT) 注7)へ分化させ、胎盤細胞への分化過程を模倣するモデルを構築しました(図1)。一方、プライム型のヒトiPS細胞から分化させた細胞(pBAP)は胎盤細胞にはならず、遺伝子発現としては羊膜細胞に近いことも分かりました。
この研究成果は2021年4月8日午前0時(日本時間)に米国科学誌「Cell Stem Cell」でオンライン公開されます。
研究の背景
ナイーブ型iPS細胞は、現行のプライム型iPS細胞と比較すると、より多くの細胞に分化できる能力を持つことが報告されています。研究グループは、ナイーブ型iPS細胞を用いて、胎盤への分化に着目し、研究を実施しました。
胎盤は胎児に酸素や栄養を届ける役割を持つため、妊娠を維持する上でとても重要な臓器です。胎盤の主な機能を担う栄養膜細胞の分化過程に異常が起こると、妊娠高血圧症候群や胎児発育不全などの胎盤に関連した合併症が引き起こされると考えられています。よって、子宮内の栄養膜細胞の発生過程(特に、受精卵着床後の数週間)を調べることはとても重要ですが、技術点な面でも、倫理的な面でも、実際に調べることは難しい状況でした。
これまで、マウスの栄養膜細胞の発生についての研究はされていましたが、発現する遺伝子などで、ヒトの栄養膜細胞の発生とは異なる点が多くありました。一方、ヒトの栄養膜細胞の研究は絨毛注8)癌の細胞を使ったものがありましたが、この細胞は正常細胞とは異なる性質を持つ癌細胞であるため、正常状態の発生モデルに置き換えることは難しいという問題がありました。2018年には、幾つかの研究グループが妊娠5-9週目のヒトの胎盤又は胚盤胞を元に、体外で2次元又は3次元の栄養膜細胞オルガノイド注9)を作製することに成功していますが、 実際に体内の栄養膜細胞の発生を再現できているのかは確かめられていませんでした。
もう1つの手法として、ヒトの多能性幹細胞(iPS細胞/ES細胞)を用いる方法があります。プライム型の多能性幹細胞を用いた研究では、体内の栄養膜細胞と比べると、複数のタンパク質が異なることが分かりました。最近では、ナイーブ型の多能性幹細胞を使った研究が確立されてきており、プライム型よりも子宮着床前の受精卵に類似した性質を持つとされて注目されています。しかし、これまでのところ、ナイーブ型多能性幹細胞を用いて栄養膜細胞の発生の出発点である栄養外胚葉(TE)を作製したという報告はなく、栄養膜細胞の発生モデルは確立されていませんでした。
研究結果
1)ナイーブ型iPS細胞から栄養外胚葉(TE)を作製した
これまでの研究で、多能性幹細胞にBMP4を加えることで栄養膜細胞への分化誘導が出来ることが分かっていました。本研究では、ヒトの受精卵が発現しているタンパク質を調べ、ヒトの栄養外胚葉へ分化誘導するには、A83-01、PD0325901、JAK inhibitor Iという3つの因子も重要であることを突き止め、これら4因子を混ぜた培養液を用いることにしました。スクリーニング注10)によって4因子の調整を行い、最適化したタイミングと比率で培養を行うと、培養3日目には約60%の割合で、多角形で平面的な形をした細胞が作製出来ました(図2(b))。蛍光免疫染色を行うと、TEのマーカーとなるタンパク質が発現していること(図2(c))、OCT3/4などの多能性因子が発現していないことを確かめました。さらに、RNA-seq解析注11)によって細胞の遺伝子発現を調べたところ、上位25の遺伝子がTE特有のものであることが分かりました。よって、ナイーブ型iPS細胞からTEへ分化誘導できたと結論づけました。
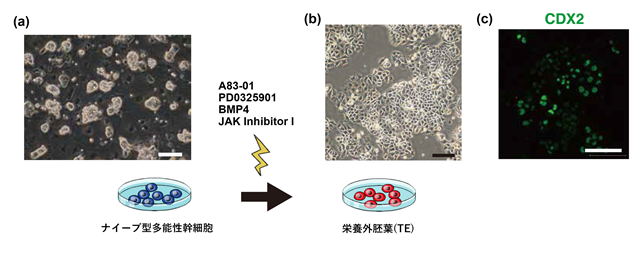
(b)栄養外胚葉(TE)の顕微鏡写真(スケールバーは100μm)
(c)例として、TEのマーカーであるCDX2で蛍光免疫染色したTEの写真(スケールバーは100μm)。発現部分が緑色で示される。
2)栄養外胚葉(TE)から細胞性栄養膜細胞(CT)、およびCTオルガノイドを作製した
通常、ヒトの体内においては、胚盤胞の栄養外胚葉(TE)は着床直後に細胞性栄養膜細胞(CT)へと分化します。胎盤の蛍光免疫染色を行うことで、分裂増殖が盛んなCTの性質を調べ、A83-01、CHIR99021、EGFの3因子がCTへの分化と維持に重要であることを確認しました。胎盤由来栄養膜幹細胞を維持する培地はこれまでに報告されていますが、本研究においてさらに安定した状態を保つことができる培地を開発しました。この最適化された培地は、ナイーブ型iPS細胞由来、胎盤由来の細胞性栄養膜細胞の両者に応用することができます。
さらに、これまでに報告された胎盤から栄養膜細胞オルガノイドを作製する手法で、CTから3次元のオルガノイドを培養しました。このオルガノイドは2ヶ月間保つことが可能で、胎盤から作った栄養膜細胞オルガノイドと極めて似た構造を持つことが観察できました。蛍光免疫染色を行うと、CTのマーカーであるITGA6が表面上で発現していることを示し(図3(b)下)、栄養膜オルガイドの表面はCTで構成されていることが分かりました。
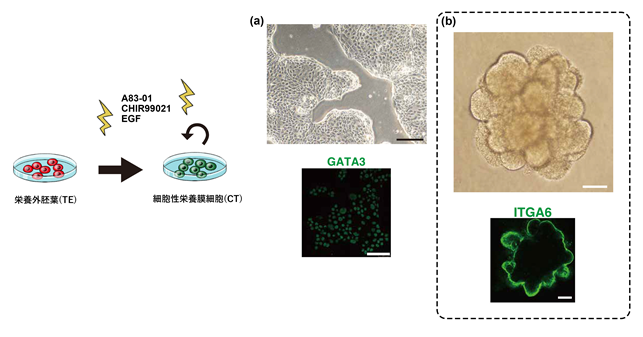
下:例として、CTのマーカーであるGATA3で蛍光免疫染色したCTの写真(スケールバーは100μm)。発現部分が赤色で示される。
(b) 上:CTオルガノイド顕微鏡写真(スケールバーは100μm)
下:例として、CTのマーカーであるITGA6で蛍光免疫染色したCTオルガノイドの写真(スケールバーは100μm)。発現部分が緑色で示される。オルガノイドの外側表面部分に発現が見られる。
本研究で作製したCTは自己複製能が高く、遺伝子発現や形態もヒトの胎盤から作った栄養膜細胞オルガノイドと似ていることから、栄養膜幹細胞のような細胞とみなすことが出来ます。
3)細胞性栄養膜細胞(CT)から合胞体栄養膜細胞(ST)、絨毛外栄養膜細胞(EVT)を作製した
細胞性栄養膜細胞(CT)は、ヒトの体内では合胞体栄養膜細胞(ST)と絨毛外栄養膜細胞(EVT)の両方へ分化できる細胞です。これまでに報告されたSTとEVTへ分化誘導させる培地を用いて、本研究で作製したCTがSTとEVTに分化できるかを確かめました。ST誘導培地で培養した細胞を電子顕微鏡で観察すると、体内のものと同様、微絨毛(極小の突起)が多数あり(図4(a)左)、蛍光免疫染色によってSTのマーカーとなるタンパク質が発現していることが確認できました(図4(a)右)。
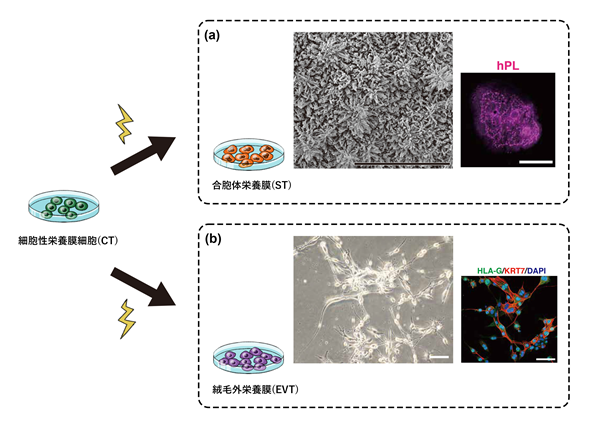
右:例として、STのマーカーであるhPLで蛍光免疫染色したSTの写真(スケールバーは100μm)。発現部分が桃色で示される。
(b) 左:絨毛外栄養膜細胞(EVT)の位相差顕微鏡写真(スケールバーは100μm)
右:EVTのマーカーであるHLA-Gを含むEVTの蛍光免疫染色写真(スケールバーは100μm)。HLA-Gの発現部分が緑色で示される。
また、EVT誘導培地で培養した細胞を観察すると、体内のものと同様、紡錘形をしていることが見られました(図4(b)左)。さらに、EVTのマーカーであるHLA-Gの発現も蛍光免疫染色によって確かめられました(図4(b)右)。
以上より、ナイーブ型のヒトiPS細胞から栄養外胚葉(TE)、TEから細胞性栄養膜細胞(CT)へ、CTから栄養膜細胞の最終形態である合胞体栄養膜細胞(ST)と絨毛外栄養膜細胞(EVT)へと分化させることに成功し、栄養膜細胞の起源から最終段階までを模倣する試験管内モデルを確立しました。
4)CTとプライム型iPS細胞から作った栄養膜様細胞(pBAP)、サル、ヒトの栄養膜細胞を比較した
最後に、本研究のモデルで作製したナイーブ型iPS細胞由来の細胞性栄養膜細胞(CT)を、プライム型iPS細胞から作った栄養膜様細胞(pBAP)、胎齢15日目のサルの胚、妊娠5週目で生検したヒトの絨毛膜絨毛(絨毛膜の面)と比較しました。
これまでの研究で、プライム型多能性幹細胞はBMP4などのタンパク質の入った培地で培養すると、栄養膜“のような”細胞が作製できることが報告されています。本研究でも同様の方法でプライム型iPS細胞から栄養膜様細胞(pBAP)を作製し、ナイーブ型iPS細胞から作製した細胞性栄養膜細胞(CT)と比べました。両者とも、KRT7やGATA3などの栄養膜細胞のマーカーが発現していることは確認できましたが、HLAクラスIと19番染色体上のマイクロRNA注12)などの発現の有無に違いがあり、CTはpBAPよりもヒトの胎盤から作製した栄養膜幹細胞と同等の発現状態を示していることが分かりました。
さらに、体内の着床直後における栄養膜細胞と比較するため、倫理的承認を得たカニクイザルの胎齢15日目の胚と、妊娠5週目で生検したヒトの絨毛膜絨毛、CTとpBAPの蛍光免疫染色を行いました(図5)。すると、HSD3Bなどの栄養膜細胞に特徴的な遺伝子が、pBAP以外では発現しているのに対し、pBAPでは発現してないことが分かりました。
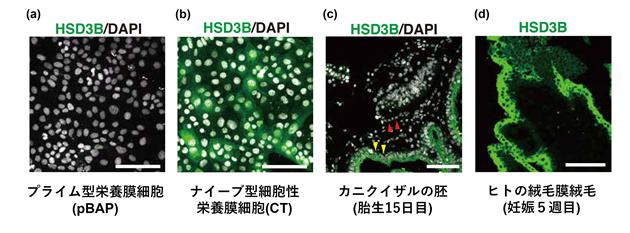
スケールバーは100μm。pBAP以外、HSD3Bの発現部分が緑色で示されるのが見られる。
※妊娠5週目のヒトの絨毛膜絨毛サンプルは胎齢15日目のカニクイザルの胚より発生が進んだ状態
以上より、CTとpBAPは別物であり、CTの方が実際の栄養膜細胞に近いことが明らかになりました。また、CTとpBAPについて、栄養膜細胞ではなく、カニクイザルとヒトの羊膜細胞とで遺伝子発現を比べたところ、pBAPの方が羊膜に特徴的な遺伝子が多く発現していることが分かりました。さらに、RT-qPCR注13)やフローサイトメトリー解析注14)でも、pBAPはCTよりも羊膜に近い性質を示しました。
本研究の意義と今後の課題
本研究では、体外において、ヒトのナイーブ型iPS細胞を用いて、これまで達成されなかった着床前からの胎盤細胞への分化過程を模倣するモデルを構築することが出来ました。これは、栄養膜細胞の着床期発生を体外で再現できたことを意味します。
ヒトの初期胚の研究は、サンプルの少なさや14日ルール注15)などの倫理的な規制から進めることが難しい分野でした。iPS細胞を含む多能性幹細胞は大量に作製することが出来るため、サンプル数を増やすことができ、遺伝子編集など、さまざまな実験を行うことが出来ます。本研究で構築されたモデルは、従来の倫理的規制を遵守したまま、初期胚の研究の可能性を広げ、将来、不妊症や、胎盤に関連した妊娠合併症の病態解明に繋がることが期待できます。
現在、プライム型iPS細胞から体細胞へ分化させる方法は数多く存在しますが、発生ステージが異なるナイーブ型iPS細胞の分化シグナルは不明な点が多くあります。本研究結果は、ナイーブ型iPS細胞がプライム型とは異なる分化シグナルを持つことを示唆します。今後、ナイーブ型iPS細胞を用いて、胎盤以外の細胞へ分化させる研究が発展することも期待されます。
論文名と著者
- 論文名
- “Capturing Human Trophoblast Development with Naïve Pluripotent Stem Cells In Vitro.”
- ジャーナル名
- Cell Stem Cell
- 著者
- Shingo Io1,2,3*, Mio Kabata1, Yoshiki Iemura1, Katsunori Semi1, Nobuhiro Morone4, Atsutaka Minagawa1, Bo Wang1, Ikuhiro Okamoto2,5, Tomonori Nakamura2,5,6, Yoji Kojima1,2,5, Chizuru Iwatani7, Hideaki Tsuchiya7, Belinda Kaswandy1, Eiji Kondoh2, Shin Kaneko1, Knut Woltjen1, Mitinori Saitou1,2,5, Takuya Yamamoto1,5,7,8, Masaki Mandai2, Yasuhiro Takashima1**
- 著者の所属機関
-
- 京都大学iPS細胞研究所(CiRA)
- 京都大学大学院医学研究科
- 日本学術振興会
- ケンブリッジ大学
- 京都大学高等研究院ヒト生物学高等研究拠点(ASHBi)
- 京都大学白眉センター
- 滋賀医科大学
- 国立研究開発法人日本医療研究開発機構(AMED)
- 理化学研究所革新知能総合研究センター(AIP)
- *:筆頭著者、**:責任著者
本研究への支援
本研究は、下記機関より支援を受けて実施されました。
- 国立研究開発法人日本医療研究開発機構(AMED)再生医療実現拠点ネットワークプログラム iPS細胞研究中核拠点[20bm0104001]、幹細胞・再生医学イノベーション創出プログラム[20bm0704035, 20bm0704032]
- 日本学術振興会(JSPS)科研費[16H02465, 19J13503, 20H05762, 20H05361]
- iPS細胞研究基金
- 公益財団法人 武田科学振興財団
- 公益財団法人 内藤記念科学振興財団
用語説明
- 注1) ナイーブ型多能性幹細胞
- 着床前の胚(胚盤胞段階のエピブラスト)に類似した性質を有する多能性幹細胞を指す。2014年に初めて樹立が報告された。
- 注2) 栄養外胚葉(trophectoderm: TE)
- 胎盤胞の外側に位置する細胞。胎盤細胞の発生の出発点となり、将来胎盤を作る細胞。
- 注3) 再生医療用iPS細胞ストック・プロジェクト
- HLAホモ接合体の細胞を有する健康なドナーからiPS細胞を作製し、あらかじめ様々な品質評価を行った上で、再生医療に使用可能なiPS細胞株を保存するプロジェクト。
- 注4) プライム型多能性幹細胞
- 着床後の胚(エピブラスト)に類似した性質を有する多能性幹細胞を指す。2007年に4因子を用いて樹立を公表されたヒトiPS細胞はプライム型多能性幹細胞に分類される。
- 注5) 細胞性栄養膜細胞(cytotrophoblast: CT)
- 着床後、栄養外胚葉(TE)が分化した細胞。自己複製能を持ち、合胞体栄養膜細胞注6)と絨毛外栄養膜細胞注7)への分化能を持つため、栄養膜幹細胞とみなされている。
- 注6) 合胞体栄養膜細胞(syncytiotrophoblast: ST)
- 栄養膜細胞のうち、母体血と接触する外側の細胞層を指す。細胞表面に無数の微絨毛が存在する。栄養およびガスの交換や、妊娠に特徴的なホルモンを分泌する役割を持つ。
- 注7) 絨毛外栄養膜細胞(extravillous trophoblast: EVT)
- 絨毛の母体側および子宮内部に浸潤する細胞。母体からの血の流れを制御したり、母体の免疫系から胎児を守る役割を持つ。
- 注8) 絨毛
- 胎盤の内側を覆う、突起が集まった層。小腸の内側にも同じ構造の腸絨毛が存在する。栄養吸収を助けるために表面積を増やすための仕組み。
- 注9) オルガノイド
- 多能性幹細胞や組織幹細胞から分化誘導された組織で、生体で認められるような立体構造や機能を保持しているもののこと。
- 注10) スクリーニング
- ランダムな母集団からある特定の目的に応じた部分集合、サンプルを抽出する操作。
- 注11) RNA-seq解析
- 高速シーケンサーを用いてRNA のシーケンシング(配列情報の決定)を行い、細胞内で発現するトランスクリプトーム(細胞内の全転写産物・全RNA)の定量を行う解析。
- 注12) マイクロRNA
- 20~30塩基程度の長さの短いノンコーディング(タンパク質をコードしていない)RNA。相補的な配列を持つmRNAと結合して翻訳を抑制したり、mRNAを分解したりすることで、そのmRNAからのタンパク質の合成を抑制する働きをもつと考えられている。特に、19番染色体上のマイクロRNAの発現は胎盤に特徴的と考えられている。
- 注13) RT-qPCR
- 逆転写酵素によりRNAを相補的なDNA(cDNA)に変換し、cDNAを用いてPCR(ポリメラーゼ連鎖反応)を行う実験手法で、遺伝子発現の有無やその量を調べることができる。また、実験や遺伝子の同定と単離を行う時にも用いられる。
- 注14) フローサイトメトリー解析
- 流動細胞計測法による解析。レーザー光を用いて光散乱や蛍光測定を行うことにより、水流の中を通過する単一細胞の大きさ、DNA量など、細胞の生物学的特徴を解析することができる。
- 注15) 14日ルール
- 国際幹細胞学会(ISSCR)が規定する幹細胞研究に関するガイドラインにおいて、ヒト胚は受精後14日、または原始線条の形成以降、試験管内で発生させることが禁じられている。
お問い合わせ先
本件担当
京都大学iPS細胞研究所(CiRA) 研究支援部門
国際広報室 大内田 美沙紀
TEL:075-366-7005 FAX:075-366-7034
Email:cira-pr”AT”cira.kyoto-u.ac.jp
AMED事業について
国立研究開発法人日本医療研究開発機構(AMED)
再生・細胞医療・遺伝子治療事業部 再生医療研究開発課
TEL:03-6870-2220 FAX:03-6870-2242
E-mail:saisei”AT”amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
関連リンク
掲載日 令和3年4月8日
最終更新日 令和3年4月8日


