プレスリリース アルツハイマー病に対する光認知症療法の開発に向けて
プレスリリース
東京大学
日本医療研究開発機構
発表者
富田 泰輔(東京大学大学院薬学系研究科 機能病態学教室 教授)
堀 由起子(東京大学大学院薬学系研究科 機能病態学教室 講師)
金井 求(東京大学大学院薬学系研究科 有機合成化学教室 教授)
相馬 洋平(東京大学大学院薬学系研究科 有機合成化学教室 医薬機能グループリーダー(研究当時))
発表のポイント
- アルツハイマー病において凝集・蓄積したアミロイドbペプチド(Ab)に対して、光照射と光酸素化触媒を用いた光酸素化法を確立し、凝集抑制と凝集Ab除去という2つの作用を明らかにしました。
- 光酸素化された凝集Aβはミクログリア細胞内のリソソーム分解酵素による分解が亢進しているという、除去効果メカニズムの一端も明らかになりました。
- アルツハイマー病患者死後脳サンプルを用いて、患者脳内に蓄積したAβに対しても光酸素化が可能であることを示しました。光酸素化法がアルツハイマー病に対する新規治療戦略となりうることが示唆されました。
発表概要
高齢化社会といわれる現在、高齢者認知症の多くを占めるアルツハイマー病(AD)は大きな社会問題となっています。脳内でのアミロイドβペプチド(Aβ)の凝集・蓄積がAD発症の原因であることから、Aβの凝集を抑制すること、また凝集したAβを効率よく除去することがAD根本治療戦略として考えられていますが、未だ根本治療法確立には至っていません。
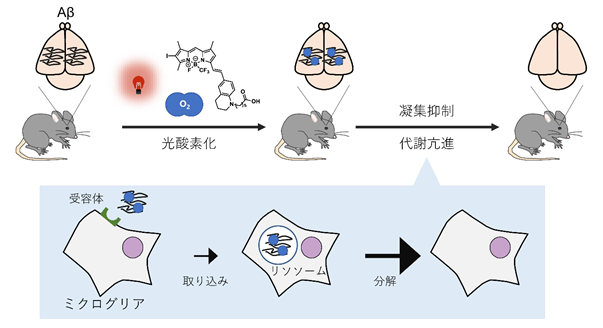
そこで、東京大学大学院薬学系研究科機能病態学教室の富田泰輔教授、堀由起子講師、小澤柊太大学院生らと、同大学大学院有機合成化学教室の金井求教授、相馬洋平医薬機能グループリーダー(研究当時)らの研究グループは、日本医療研究開発機構(AMED)戦略的国際脳科学研究推進プログラム 先進的個別研究開発課題の「神経変性疾患治療を目指した光酸素化による細胞内アミロイドの動態制御」(JP20dm0307030)をはじめとする支援のもと、光照射によって活性化する光酸素化触媒(注1)を用い、人為的に凝集Aβ選択的に酸素を付加する光酸素化法を開発しました。月齢依存的に脳内にAβが蓄積するADモデルマウス(注2)を用いて、生きたマウス脳内で反応を行うin vivo光酸素化反応系を確立してその作用を評価したところ、凝集Aβ選択的な光酸素化は、Aβのさらなる凝集を抑制し、また凝集Aβを脳内から効率的に除去できることを明らかにしました(図1)。加えて、光酸素化した凝集Aβの除去においては脳内免疫担当細胞であるミクログリア(注3)が関与し、ミクログリア細胞内のリソソーム分解酵素(注4)による分解が亢進していることも明らかとなり、除去効果メカニズムの一端も示されました(図1)。さらに、アルツハイマー病患者死後脳サンプルを用いて、患者脳内に蓄積したAβに対しても光酸素化が可能であることを示しました。
本研究成果は、凝集Aβに対する光酸素化法の新規AD根本治療戦略としての可能性を示した点で大変意義のある成果です。また光酸素化触媒はアミロイドに共通の立体構造に対して反応し活性化することから、パーキンソン病(注5)や筋萎縮性側索硬化症(注6)などの、AD以外のアミロイド形成・蓄積を原因とする多くの神経変性疾患に対しても有用である可能性が期待されます。
発表内容
高齢化社会といわれる現在、高齢者認知症の多くを占めるアルツハイマー病(AD)は大きな社会問題となっています。ADに特徴的で最初期に見られる病理学的所見として、脳内でアミロイドβペプチド(Aβ)が異常に凝集して「アミロイド注7)」と呼ばれる構造をとり蓄積した病理構造物があげられます。これまでの多くの研究から、このAβの凝集・蓄積がAD発症の原因であることが示唆されています。そのため、Aβの凝集を抑制すること、また凝集したAβを効率よく除去することがAD根本治療戦略として考えられていますが、未だ根本治療法確立には至っていません。
そこでこれまで、東京大学大学院薬学系研究科機能病態学教室の富田泰輔教授らの研究グループでは、Abのさらなる凝集を抑制することを目的に光酸素化法の開発を行ってきました。光酸素化法は、光照射と、光によってアミロイド選択的な酸素化活性をもつ低分子化合物である光酸素化触媒を用い、アミロイドに対して酸素を付加する手法です。アミロイドとして凝集Abを用いて本法による酸素化を検討すると、凝集Ab選択的に酸素化できること、さらなる凝集が抑制されることを明らかにしました。さらに、生きたマウス脳内で光酸素化反応を行うin vivo光酸素化反応系を確立し、月齢依存的にAβが脳内に蓄積するADモデルマウス脳内で反応を行いその作用を評価したところ、凝集Aβ選択的な光酸素化は、Aβのさらなる凝集抑制作用のみならず、定期的に反応を継続することで、凝集Aβの脳内からの効率的な除去作用をも有することが明らかになりました(図1)。この凝集Aβ除去促進効果には脳内免疫担当細胞であるミクログリアが関与しており、その代謝亢進メカニズムとして、光酸素化された凝集Aβはミクログリア細胞内のリソソーム分解酵素による分解が亢進していることも明らかになりました(図1)。これらの結果は、光酸素化法が新規AD根本治療戦略となりうることを示唆しています。
ヒトAD患者の死後脳サンプルを用いた検討により、AD患者脳内に蓄積しているAβに対しても、本光酸素化法によって酸素化できることが明らかになりました。この結果は、本法を用いてAD患者脳内に蓄積するAβを酸素化できれば、脳内から速やかに凝集Aβを除去することでAD病態を改善できる可能性を示唆しています。
本研究成果は、凝集Aβに対する光酸素化が、さらなる凝集抑制効果と凝集Aβの除去という2つの効果を有し、新規AD根本治療戦略となりうる可能性を示した点で大変意義のある成果です。また光酸素化触媒はアミロイドに共通の立体構造に対して反応し活性を示すことから、パーキンソン病や筋萎縮性側索硬化症などの神経変性疾患、さらには末梢にアミロイドが蓄積する様々な末梢性アミロイドーシス(注8)など、AD以外のアミロイド形成・蓄積を原因とする多くの疾患に対しても有用である可能性が期待されます。今後、酸素化活性の更なる向上や治療応用に向けた改良を行うことにより、本法が新規AD根本治療法として確立することが期待されます。
本研究は、日本医療研究開発機構(AEMD)[戦略的国際脳科学研究推進プログラム 先進的個別研究開発課題(JP20dm0307030:研究代表 堀由起子)、戦略的国際共同研究プログラム(JP19jm0210058:研究代表 相馬洋平)]、および、日本学術振興会(JSPS)[科学研究補助金 基盤研究(C)(18K06653:研究代表 堀由起子)、若手研究(A)(16H06216:研究代表 相馬洋平)、挑戦的萌芽研究(19K22484:研究代表 相馬洋平)、基盤研究(A)(15H02492, 19H01015:研究代表 富田泰輔, 20H00489:研究代表 金井求)]、テルモ生命科学振興財団助成(研究代表 相馬洋平)の支援を受けて実施いたしました。
発表雑誌
- 雑誌名
- 「Brain」
- 論文タイトル
- Photo-oxygenation by a biocompatible catalyst reduces amyloid-β levels in the brains of Alzheimer’s disease model mice
- 著者
- Shuta Ozawa, Yukiko Hori, Yusuke Shimizu, Atsuhiko Taniguchi, Takanobu Suzuki, Wenbo Wang, Yung Wen Chiu, Reiko Koike, Satoshi Yokoshima, Tohru Fukuyama, Sho Takatori, Youhei Sohma*, Motomu Kanai*, and Taisuke Tomita*
(*:Corresponding author) - DOI番号
- 10.1093/brain/awab058
用語解説
- 注1)光酸素化触媒:
- 光によって励起されることで酸素を付加(酸素化)する触媒活性をもつ低分子化合物。アミロイド選択的な結合能も有することにより、アミロイド選択的な光酸素化反応を起こす。
- 注2)ADモデルマウス:
- 家族性AD変異を有する、Abの前駆体タンパク質であるヒトAPPをノックイン、あるいは神経細胞に過剰発現させることにより、月齢依存的にAbが脳内に蓄積し、AD病態の一部を再現したマウス。
- 注3)ミクログリア:
- 脳内細胞の一つで、免疫反応を担当していると言われている。Abを取り込み、分解することが知られている。
- 注4)リソソーム分解酵素:
- 細胞内小器官の一つであるリソソームに存在する分解酵素。リソソームは多くの分解酵素を有しており、タンパク質を分解していることが知られている。
- 注5)パーキンソン病:
- α-synucleinが、凝集して(アミロイドを形成して)細胞内に蓄積することで発症する神経変性疾患の一つ。
- 注6)筋萎縮性側索硬化症:
- TAR DNA-binding protein 43 kDa(TDP-43)が、凝集して(アミロイドを形成して)細胞内に蓄積することで発症する神経変性疾患の一つ。
- 注7)アミロイド:
- タンパク質が異常に凝集し、線維を形成した構造体。クロスbシート構造と呼ばれる、アミロイド共通の立体構造をもつ。
- 注8)末梢性アミロイドーシス:
- 肝臓、心臓、腎臓などの末梢組織にアミロイドが蓄積する疾患の総称。
お問い合わせ先
東京大学大学院薬学系研究科 機能病態学教室
教授 富田 泰輔(とみた たいすけ)
TEL:03-5841-4868
E-mail:taisuke[at]mol.f.u-tokyo.ac.jp
[at]を@に置き換えてください。
AMED事業について
日本医療研究開発機構 疾患基礎研究事業部 疾患基礎研究課
国際脳担当
TEL:03-6870-2225
E-mail:brain-m[at]amed.go.jp
[at]を@に置き換えてください。
掲載日 令和3年4月14日
最終更新日 令和3年4月14日


