プレスリリース ベタインはキネシン分子モーターの機能低下による統合失調症様の症状を改善する―KIF3分子モーターはCRMP2タンパク質を輸送し、ベタインはCRMP2タンパク質のアクチン束化能を改善し神経細胞の形態を整える―
プレスリリース
東京大学
理化学研究所
日本医療研究開発機構
発表者
吉原 壮悟(東京大学大学院医学系研究科 分子細胞生物学専攻 医学博士課程4年)
國井 泰人(福島県立医科大学会津医療センター 精神医学講座 准教授(研究当時)/東北大学災害科学国際研究所 災害精神医学分野 准教授)
吉川 武男(理化学研究所 脳神経科学研究センター 分子精神遺伝研究チーム チームリーダー(研究当時))
田中 庸介(東京大学大学院医学系研究科 分子細胞生物学専攻 細胞構築学分野講師)
廣川 信隆(東京大学大学院医学系研究科 分子細胞生物学専攻 分子構造・動態・病態学分野 特任教授(研究当時))
発表のポイント
- キネシン分子モーターKIF3の不活性化を伴う統合失調症に、既存の統合失調症治療薬とは異なる作用を持つ化合物であるベタイン(注1)が有効である可能性を、モデルマウスの実験から見出した。
- ベタインが、アクチン束化能を有するCRMP2タンパク質を輸送するKIF3(注2)不活性化を伴う統合失調症脳において、CRMP2タンパク質の有害なカルボニル化修飾(注3)の軽減によりCRMP2の輸送不全を補い、神経細胞の形態異常を改善することが治療の基盤となる可能性を初めて示した。
- 統合失調症の新しい発症機構の解明を通して、統合失調症における分子標的治療・創薬、及び発症予防法の開発基盤となることが期待される。
発表概要
統合失調症は、一般人口の約100人に1人の割合で発症する頻度の高い精神疾患であり、生涯にわたって生活の質が損なわれる可能性が高い疾患です。現在、統合失調症の治療薬は、薬効が不十分であること、また副作用に悩まされる患者が多くいることから、従来とは作用機序の異なる治療薬の開発が喫緊の課題となっています。統合失調症患者の血液中の代謝産物を網羅的に測定した結果、一部の患者で、健常者と比べてベタインの濃度が低下しているという研究成果が報告されています。そこで、東京大学大学院医学系研究科の廣川信隆特任教授(研究当時)、田中庸介講師、理化学研究所の吉川武男チームリーダー(研究当時)、福島県立医科大学の國井泰人准教授(研究当時)らの共同研究グループは、ベタインを補充することが統合失調症の治療に繋がると考え、モデル動物であるキネシン分子モーターKIF3遺伝子ヘテロ欠損マウスを用いた研究を行いました。本研究成果から、ベタインがこのマウスの統合失調症様の症状を改善するとともに、KIF3の輸送タンパク質であるCRMP2の有害なカルボニル化修飾を軽減することにより、CRMP2の輸送障害における神経細胞の形態異常を改善することで、症状を緩和させていることを明らかにしました。ベタインは既に承認されている薬剤であるため、現在、東京大学医学部附属病院精神神経科にて臨床研究を行っており、今後新規統合失調症治療薬としての承認が期待されます。
発表内容
東京大学大学院医学系研究科の廣川信隆特任教授(研究当時)、田中庸介講師、理化学研究所の吉川武男チームリーダー(研究当時)、ならびに福島県立医科大学の國井泰人准教授(研究当時)らのAMED融合脳研究グループは、ヒトで変異が報告されているKIF3モーターサブユニットであるKIF3B遺伝子をヘテロ欠損させたマウスにベタインを投与したところ、統合失調症様の行動異常のうち、特に社会性の低下及びプレパルス・インヒビション(注4)に著明な改善がみられることを明らかにしました。これらの行動変化の要因を探索するため、大脳皮質ならびに初代培養海馬において神経細胞の形態観察を行ったところ、KIF3B遺伝子ヘテロ欠損神経細胞では樹状突起の過剰形成が生じており、この形態異常は高ベタイン餌や培地へのベタイン添加によって著明な改善がみられました。また、この樹状突起過剰形成はカルボニルストレス軽減剤として知られているピリドキサミンによっても改善したことに加え、カルボニルストレス除去遺伝子に変異が入った統合失調症患者由来のiPS細胞においても神経突起の過剰形成が観察されたことから、ベタインはカルボニル化修飾を抑制し樹状突起の過剰形成を抑制する作用があることが示唆されました。
次に、樹状突起の過剰形成の原因を探索するため、幼若期(培養1日目)の海馬神経細胞をライブイメージングしたところ、KIF3B遺伝子ヘテロ欠損海馬神経細胞のラメリポディア(注5)内のアクチン束の顕著な喪失が確認されました。これにより、アクチン束の回転によって誘導されるラメリポディア全体のダイナミックな運動も喪失し、その結果微小管がラメリポディアの奥深くまで侵入し樹状突起の過剰形成をもたらしてしまうことが示唆されました。これらの異常も培地へのベタイン添加によって著明な改善がみられました。
そこで、これらの表現型の責任分子として、生化学的な手法によりCRMP2を同定しました。野生型海馬神経細胞においてCRMP2をノックダウンすると樹状突起が過剰に形成され、逆にKIF3B遺伝子ヘテロ欠損海馬神経細胞にCRMP2を大量に発現させると樹状突起の過剰形成が抑制されたため、CRMP2はKIF3モーターの主要カーゴとして樹状突起の形成を抑制していることが分かりました。また、これまでの同グループの研究から、CRMP2はカルボニルストレスの主要な標的であることが明らかとなっているため、CRMP2がベタインの作用点であることも強く示唆されました。
さらに、CRMP2の免疫染色を行ってみると、野生型海馬神経細胞のラメリポディアにおいてCRMP2はアクチン束上と外周部に特に多く局在していましたが、KIF3B遺伝子ヘテロ欠損海馬神経細胞では、これらの部位から消失していることが分かりました。そこで生化学的にアクチンとCRMP2の結合実験を行ったところ、CRMP2はアクチン束化能を有しており、カルボニル化修飾によりその能力を喪失することが明らかになりました。またCRMP2はカルボニル化修飾を強く受けると有害な多量体を形成してしまう性質がありますが、マウス脳内のCRMP2を分析したところ、高ベタイン餌摂食マウス脳では有害なCRMP2多量体の量が実際に軽減しており、生体においてもベタインがCRMP2の活性化に有効であることが分かりました。
以上の結果から、ベタインは、KIF3によるCRMP2輸送が低下している状況下においても、カルボニルストレスを減少しCRMP2のカルボニル化修飾による多量体化を軽減してCRMP2を活性化することができます。するとアクチン束化能を有した正常なCRMP2が復活し、ラメリポディアのアクチン束が正常に形成されて樹状突起の過剰形成を抑制することにより、統合失調症の症状を緩和している可能性が示唆されました(図1)。
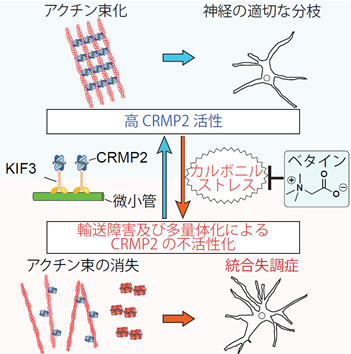
動物実験に加え、福島ブレインバンク、新潟ブレインバンクから供与されたヒト死後脳を解析したところ、統合失調症患者群においてKIF3の発現量が低下している知見が得られたため、KIF3と統合失調症との関連性が更に強固となりました。ベタインは既に承認されている薬剤であるため、これまでAMEDの支援の下、東京大学医学部附属病院精神神経科にて臨床試験を実施しており、薬効や安全性評価のためのデータを収集しています。さらなる検証を通して、今後新規統合失調症治療薬としての承認が期待されます。
本研究は日本医療研究開発機構(AMED)脳科学研究戦略推進プログラム『臨床と基礎研究の連携強化による精神・神経疾患の克服(融合脳)』の「細胞内分子モーターKIF3, KIF17の発達障害・統合失調症における役割の解明・新規治療法の開発及びホモシステイン代謝経路に注目した統合失調症の新規治療薬の開発(代表:廣川信隆)」による支援を受けて行われました。
発表雑誌
- 雑誌名
- 「Cell Reports」(電子版 35巻 2号、2021年4月13日)
- 論文タイトル
- Betaine ameliorates schizophrenic traits by functionally compensating for KIF3-based CRMP2 transport
- 著者
- Shogo Yoshihara, Xuguang Jiang, Momo Morikawa, Tadayuki Ogawa, Sotaro Ichinose, Hirooki Yabe, Akiyoshi Kakita, Manabu Toyoshima, Yasuto Kunii, Takeo Yoshikawa, Yosuke Tanaka, and Nobutaka Hirokawa
- 発表者
- 吉原 壮悟(東京大学大学院医学系研究科 分子細胞生物学専攻 医学博士課程4年)
- 蒋 緒光(東京大学大学院医学系研究科 分子細胞生物学専攻 医学博士課程4年(研究当時))
- 森川 桃(理化学研究所 脳神経科学研究センター 分子精神遺伝研究チーム 訪問研究員(研究当時)/日本学術振興会 特別研究員 SPD)
- 小川 覚之(東京大学大学院医学系研究科 分子細胞生物学専攻 細胞構築学分野 助教(研究当 時))
- 一ノ瀬 聡太郎(東京大学大学院医学系研究科 特任研究員(研究当時))
- 矢部 博興(福島県立医科大学 神経精神医学講座 主任教授)
- 柿田 明美(新潟大学 脳研究所 病理学分野 教授)
- 豊島 学(理化学研究所 脳神経科学研究センター 分子精神遺伝研究チーム 研究員(研究当時))
- 國井 泰人(福島県立医科大学会津医療センター 精神医学講座 准教授(研究当時)/東北大学災害科学国際研究所 災害精神医学分野 准教授)
- 吉川 武男(理化学研究所 脳神経科学研究センター 分子精神遺伝研究チーム チームリーダー(研究当時))
- 田中 庸介(東京大学大学院医学系研究科 分子細胞生物学専攻 細胞構築学分野 講師)
- 廣川 信隆(東京大学大学院医学系研究科 分子細胞生物学専攻 分子構造・動態・病態学分野 特任教授(研究当時))
用語解説
- (注1)ベタイン:
- アミノ酸であるグリシンのアミノ基に三つのメチル基が付加した化合物。既に承認されている薬剤であり、ホモシスチン尿症という遺伝性疾患の治療薬として用いられている。
- (注2)キネシン分子モーターKIF3B:
- 45種類あるキネシンスーパーファミリータンパク質の一種であり、神経系に多く発現する。KIF3A, KAP3タンパク質とともにKIF3モーターを形成し、微小管というレールに沿ってタンパク質などの積み荷を運ぶことで、細胞の生存、形態形成および機能発現に重要な役割を果たしている。統合失調症患者のゲノムにおいて、KIF3Bに機能的欠損をもたらす遺伝子変異が同定されている。
- (注3)CRMP2タンパク質のカルボニル化修飾:
- 酸化ストレスなどの影響により、生体内において反応性カルボニル化合物がタンパク質・糖・脂質などを非酵素的に修飾し、不活性化してしまうことをカルボニル化といい、これらが蓄積した状態をカルボニルストレスという。CRMP2はその主要な標的であると報告されており、統合失調症において、カルボニル化修飾を受けたCRMP2タンパク質が多量体化して細胞骨格の制御機能を失うことが疾患病態の基盤にある可能性が示唆されている。
- (注4)プレパルス・インヒビション:
- 驚愕刺激の直前に微弱な刺激が先行することにより驚愕反応が抑制される現象。統合失調症患者および統合失調症の動物モデルの両方で低下が見られるため、統合失調症の解析に用いられる。
- (注5)ラメリポディア:
- アクチン細胞骨格によって制御される細胞周縁部にある膜状の非常に動的な構造であり、その運動性が微小管の侵入を抑制している。神経細胞の樹状突起はラメリポディアの適切な部位に微小管が侵入することで形成されるため、CRMP2によるアクチン束の形成は神経細胞樹状突起の過剰な形成を阻害する。
お問い合わせ先
研究について
東京大学大学院医学系研究科 分子細胞生物学専攻 分子構造・動態・病態学分野
特任研究員 廣川 信隆(ひろかわ のぶたか)
Tel:03-5841-3326
E-mail:hirokawa”AT”m.u-tokyo.ac.jp
AMED事業について
国立研究開発法人日本医療研究開発機構(AMED)疾患基礎研究部疾患基礎研究課
Tel:03-6870-2286
E-mail:brain-pro”AT”amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
掲載日 令和3年4月14日
最終更新日 令和3年4月14日


