プレスリリース 脳の宇宙を捉える顕微鏡―世界初、多領域にまたがる神経ネットワークのエコ特性を発見―
プレスリリース
理化学研究所
株式会社フォブ
株式会社ニコン
日本医療研究開発機構
理化学研究所(理研)脳神経科学研究センター触知覚生理学研究チームの村山正宜チームリーダーらの共同研究グループ※は、広視野・高解像度・高速撮像・高感度・無収差[1]を同時に満たす世界初の2光子顕微鏡[2]「FASHIO-2PM(fast-scanning high optical invariant two-photon microscopy)」を開発しました。
本研究成果は、脳の広域ネットワーク活動を観察できることから、知覚・認知・意思決定・運動などをつかさどる大脳新皮質の動作原理の解明に貢献し、また免疫、がん、植物など、さまざまな生物分野での利用が期待できます。
脳はさまざまな領域の集合体であり、領域間の相互作用により脳機能が発現すると考えられています。しかし従来の顕微鏡では、観察視野が狭い、または視野は広くても、空間解像度が低いか、神経活動の記録速度が低速でした。そのため、多領域にまたがる細胞レベルでの広域ネットワークの機能的構造は不明でした。
今回、共同研究グループは、巨大な無収差対物レンズや大口径・高感度・高出力光検出器などを開発し、これらを組み込んだ2光子顕微鏡FASHIO-2PMを構築しました。マウス大脳皮質2層に存在する1万6000個以上の神経細胞の活動を、9mm2(従来の36倍)の単一視野面から7.5Hzの撮像速度で高感度に測定することに成功しました。この単一視野面で記録された細胞数と撮像速度は世界最大・最速です。さらに、観測したデータを用いて細胞レベルでのネットワーク解析を行った結果、大脳皮質はスモールワールド性[3](情報処理においてコストがかかりにくいエコなシステム性)を持つことを世界に先駆けて発見しました。
本研究は、科学雑誌『Neuron』オンライン版(令和3年4月19日付:日本時間令和3年4月20日)に掲載されます。

※共同研究グループ
- 理化学研究所 脳神経科学研究センター
- 触知覚生理学研究チーム
- チームリーダー 村山 正宜 (むらやま まさのり)
- 研究員(研究当時) 太田 桂輔 (おおた けいすけ)
- 研究員 大石 康博 (おおいし やすひろ)
- 研究員(研究当時) 鈴木 崇之 (すずき たかゆき)
- 研究員 上森 寛元 (うわもり ひろゆき)
- テクニカルスタッフ 小林 碧 (こばやし みどり)
- テクニカルスタッフ 小田川 摩耶(おだがわ まや)
- テクニカルスタッフ 松原 智恵 (まつばら ちえ)
- 細胞機能探索技術研究チーム
- チームリーダー 宮脇 敦史 (みやわき あつし)
- 東京大学大学院
- 総合文化研究科 広域科学専攻広域システム科学系
- 准教授 大泉 匡史 (おおいずみ まさふみ)
- 特任研究員(研究当時) 池田 宗樹 (いけだ むねき)
- 情報理工学研究科知能機械情報学専攻 生命知能システム研究室
- 大学院生(修士課程) 伊藤 圭基 (いとう よしき)
- 東京工業大学 情報理工学院 情報工学系
- 准教授 青西 亨 (あおにし とおる)
- 大学院生(博士後期課程)伊東 翼 (いとう つばさ)
- 生理学研究所 行動・代謝分子解析センター ウィルスベクター開発室
- 准教授 小林 憲太 (こばやし けんた)
- 順天堂大学大学院 医学研究科 神経機能構造学講座
- 准教授 日置 寛之 (ひおき ひろゆき)
- 東北大学大学院歯学研究科・歯学部
- 教授 中井 淳一 (なかい じゅんいち)
- 九州保健福祉大学 薬学部 薬学科
- 教授 大倉 正道 (おおくら まさみち)
- 株式会社フォブ
- 開発担当役員 大出 孝博 (おおで たかひろ)
- 株式会社ニコン
- 主幹技師(研究当時) 黒岩 義典 (くろいわ よしのり)
- 主幹研究員 堀越 勝 (ほりこし まさる)
- 浜松ホトニクス株式会社
- アプリケーションエンジニア 松下 純也 (まつした じゅんや)
研究支援
本研究は、日本医療研究開発機構(AMED)「革新的技術による脳機能ネットワークの全容解明プロジェクト」の「高機能型広視野顕微鏡の開発(代表者:村山正宜)」、同「脳の構造と機能の可視化、および分子病理診断のための技術開発(代表者:宮脇敦史)」、同「透明化技術を基軸とした全脳レベルから超微細構造レベルへのズームイン法の確立(代表者:日置寛之)」、同「霊長類脳の単一ニューロンレベルの機能マップを可能にする革新的イメージング技術の開発(代表者:中井淳一)」、科学技術振興機構(JST)戦略的創造研究推進事業CREST「情報網に潜む因果構造解析と高次元脳計測による意識メータの創出(研究代表者:小村豊)」、同「神経科学の公理的計算論と工学の構成論の融合による人工意識の構築とその実生活空間への実装(研究代表者:金井良太)」、日本学術振興会(JSPS)科学研究費補助金 基盤研究B「脳活動の情報量解析による分離脳のメカニズムの解明(研究代表者:大泉匡史)」、同学術変革領域研究B「脳状態毎の超広域神経活動記録とクラスタ/ハブ細胞の選択的操作法の開発(研究代表者:村山正宜)」KAO Corp(村山)、 Cooperative Study Program (237) of the National Institute for Physiological Sciences(生理研)による支援を受けて行われました。
背景
近代神経生理学のパイオニアで、シナプスの命名者であるチャールズ・シェリントン卿(1932年ノーベル生理学・医学賞)は、彼の著書『Man on his nature』の中で、脳の働きについて次のような詩的な記述を残しています。
“The brain is waking and with it the mind is returning. It is as if the Milky Way entered upon some cosmic dance. Swiftly the head mass becomes an enchanted loom where millions of flashing shuttles weave a dissolving pattern, always a meaningful pattern though never an abiding one; a shifting harmony of subpatterns.”
彼は、膨大な神経細胞の活動を、夜空にきらめく星々として想像しました。「目が覚めると、まるで天の川が宇宙のダンスを始めたかのようだ。突如、頭の中が魔法の織機のようになり、何百万もの点滅するシャトルが幻想的なパターンを織り成す」と思いを巡らせています。シェリントン卿だけでなく、多くの科学者たちは、生きた脳から大多数の神経活動を記録することを夢見てきました。しかし、そもそもなぜ大規模記録が必要なのでしょうか。それは、脳機能の発現メカニズムのヒントがそこにあると考えられているからです。
大脳新皮質は高等生物で発達した脳領域で、知覚・認知・意思決定・運動などの機能を担っています。これらの脳機能は、複数の領域に存在する神経細胞の協調的な活動と相互作用によって発現されると考えられています注1,2)。従って、脳機能の発現メカニズムを理解するには、複数領域から同時観察(森の観察)し、かつ一つ一つの神経細胞も記録できる(木の観察)解像度と、その活動を捉える十分な記録速度が必要となります。
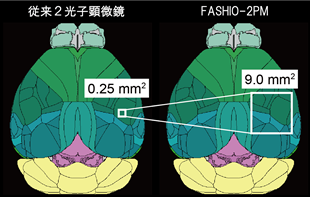
生きた動物の脳から、単一細胞の解像度で神経活動を観測するために、2光子顕微鏡によるカルシウムイメージング法[4]が利用されています。しかし、これまでの2光子顕微鏡で観察できる視野は0.25 mm2程度が限界でした(図1左)。このような狭い視野では、マウスのように小さい動物の脳でも、複数の脳領域から神経細胞を同時に観察することはできません。最近では、視野を広くした2光子顕微鏡も発表されていますが、細胞レベルの空間解像度がない、あるいは活動の記録には低速であることから、即時的な細胞間連絡を捉えることができないという限界があります。そのため、多領域にまたがる細胞レベルでの広域ネットワークの機能的構造は不明でした。
そこで、共同研究グループは、0.25mm2の36倍に相当する9mm2の視野から細胞レベルで活動を十分な速度で観測する新しい2光子顕微鏡の開発を目指しました(図1右)。
注1)2015年5月22日理化学研究所プレスリリース「“感じる脳”のメカニズムを解明」
注2)2016年5月27日理化学研究所プレスリリース「睡眠不足でも脳への刺激で記憶力がアップ」
研究手法と成果
複数の脳領域を含む広視野で観察するためには、顕微鏡は低倍率である必要があります。一方、一つ一つの神経細胞を観察するためには、高い光学的解像度を持つ顕微鏡でなければなりません。顕微鏡の光学的解像度は対物レンズの開口数(NA: numerical aperture)[5]によって決まり、開口数が高いほど光学的解像度は上がりますが、倍率を下げると開口数は低下してしまいます(図2A, B)。つまり、低倍率と高い開口数は互いにトレードオフの関係にあります。このトレードオフは、直径の大きな対物レンズにより解決できます(図2C)。
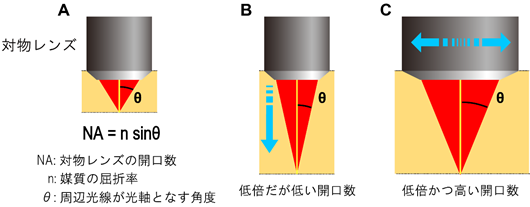
B:2光子顕微鏡の倍率は、対物レンズの焦点距離とチューブレンズ(結像レンズ)の焦点距離の比率によって定まる。青矢印のように、対物レンズの焦点距離を長くことで低倍率観察が実現すると、開口数が下がり光学的解像度が低下してしまう(広視野観察と光学的解像度のトレードオフ問題)。
C:トレードオフ問題は、青矢印のように直径の大きな対物レンズにより解決できる。
ただし、単純に直径の大きな対物レンズを製作すれば良いというわけではありません。レンズを組み合わせた光学系には、ボケやゆがみの原因となる収差が生じます。一般に、収差は視野の中心から視野の端に向かって大きくなり、光学的解像度は劣化します。
共同研究グループは厳密なシミュレーションを行い、直径の大きなレンズでありながらも視野全域にわたり、同等の光学的解像度で単一神経細胞を観察できる対物レンズを独自に設計しました。設計した対物レンズの性能を表すストレール比[6]は0.99(最大1.0)であり、これはほぼ無収差であることを示しており、他の大型レンズに比べて非常に高い値です。この対物レンズの性能を最大限に生かすための巨大チューブレンズ(結像レンズ)とスキャンレンズも設計しました(図3)。そして、これらを組み合わせて、新しい2光子顕微鏡「FASHIO-2PM(fast-scanning high optical invariant two-photon microscopy)」を開発しました。

実際に、FASHIO-2PMの視野の中心と視野中心から1.5mm離れた位置において点拡がり関数[7]を測定したところ、視野の端においても視野中心と同等の光学的解像度を持つことが確認できました(図4)。
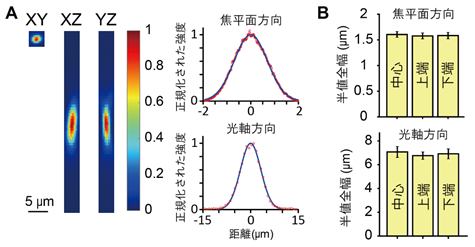
B:視野中心・上端(中心から1.5mm上部)・下端(中心から1.5mm下部)における点拡がり関数の半値全幅のまとめ。視野の端において、視野中心と同等の光学的解像度が実現できていることが確認できた。この解像度は単一神経細胞(直径およそ10μm)を観察するには十分に高い。
ここで重要なのは、時々刻々と変化する神経活動を記録するために、高い時間解像度を持つ顕微鏡システムを構築する必要があるということです。今回、開発目標とした2光子顕微鏡の基本原理は、高速に動くスキャニングミラーでレーザースポットを標本上で走査するレーザー走査型顕微鏡と同じです。神経活動をカルシウムイメージング法により計測する場合、スポット光によって励起されたカルシウムセンサー[4]からの蛍光変化を神経活動として捉えます。従って、神経活動を捉えるためには、標本上でのレーザー走査の速度を上げてカルシウムイメージングを行う必要があります。
しかし、広い視野を高速で走査すると、単位面積当たりにレーザーが滞留する時間が短くなり、明るく信号対雑音比(SN比)[8]の高い像が得られません。つまり、ここにもトレードオフ(高い時間解像度 VS. 明るくSN比の高い観察)が存在します。特に、この問題は脳表から深い位置に存在する神経細胞の活動を計測するときに深刻です。
そこで、多角的にこの問題を克服する三つの方法を考案しました。
- 対物レンズの蛍光経路の開口数を励起経路の開口数の2倍とするレンズの設計(神経活動由来の蛍光の効率的な収集が可能となる)
- 2光子励起効率を増加させるプリチャープ機構[9]の導入
- 大口径の高感度光検出器(光電子増倍管)の開発(図6C)
その結果、カルシウムイメージング法により、脳表から深さ100マイクロメートル(μm、1μmは1,000分の1mm)程度のマウス大脳皮質2層から、7.5Hzの撮像速度で1万6000個以上の神経細胞の活動を観測することに成功しました(図5)。これは、単一視野面で記録された細胞数と撮像速度としては世界最大・最速となります。

B:左図で囲まれた各領域内で検出された細胞の神経活動データ。高いSN比を示すことが分かる。
さらに、脳表から深さ500μm程度のマウス大脳皮質5層から、6,000個以上の単一神経細胞の活動を観測することに世界で初めて成功しました(図6A, B)。この結果は、浜松ホトニクス株式会社が開発した大口径の高感度光検出器を利用したことで実現しました(図6C)。脳深部においても神経活動を記録できたのは、FASHIO-2PMが高感度・無収差な光学システムを実現していることを示しています。
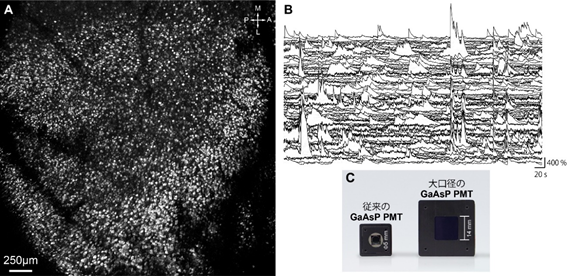
C: 従来のGaAsP PMT(光電子増倍管)と浜松ホトニクス株式会社が開発した大口径のGaAsP PMTの写真。
続いて、マウス大脳新皮質2層で観測された1万個以上の神経細胞の活動の大規模データ解析を試みました。まず、神経細胞間の機能的結合強度[10]を推定しました。その結果、これまでに発見されていなかった3mm離れた神経細胞が同期して活動していることや、100個以上の神経細胞と機能的な結合を持つハブ細胞を発見しました(図7A, B)。これらの発見は、広視野観察による大規模神経活動記録だからこそ実現した結果といえます。
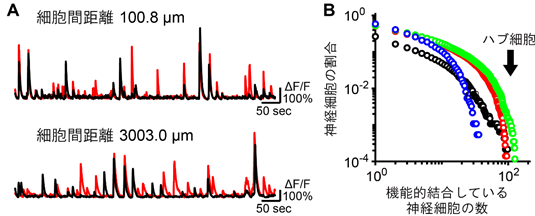
B:機能的ネットワークの次数分布。100個以上の神経細胞と機能的に結合した細胞(ハブ細胞)が観測された。分布の裾に存在する神経細胞は、100個以上の神経細胞と機能的に結合したハブ細胞と考えられる。異なる色はそれぞれ異なるマウスから記録した結果を示す。
最後に、機能的結合強度に基づいてネットワーク構造を解析しました。まず、観測された神経細胞像と機能的結合を可視化しました。すると、同一脳領域内における機能的な短距離結合が存在するとともに、脳領域をまたぐ長距離結合を発見しました(図8)。これはスモールワールドネットワークを連想させます。そこで、ネットワークの特性を定量的に解析したところ、大脳新皮質はスモールワールド性(情報処理においてコストがかかりにくいエコなシステム性)を持つことが明らかになりました。この結果は、多領域にまたがるネットワーク特性を細胞レベルで明らかにした世界初の報告となります。

B: 2,500μm以上となる機能的結合の代表例。脳領域を超えた機能的結合が確認できた。
今後の期待
シェリントン卿だけでなく、多くの科学者が生きた脳から大多数の神経活動を記録することを夢見てきました。事実、近年の神経科学では、心や脳機能のメカニズムに対してさまざまな理論や仮説が提唱されてきましたが、その中には、膨大な数の神経活動を記録できることを前提とした研究が数多くあります。脳内に存在する神経細胞の数を考えれば、その前提は不思議なことではありません。今回、2光子顕微鏡FASHIO-2PMで捉えた神経活動は、まさにシェリントン卿が想像した夜空にきらめく無数の星々です。この顕微鏡が理論研究(仮説)と実験研究(実証)のかけ橋として働き、これまで仮説にとどまっていた研究を次々と実証するものと期待できます。
今後、野生型や精神疾患モデル動物での知覚や認知、意思決定時における脳の動作原理を、従来なかった細胞レベルでの広域ネットワーク動態として捉えることが可能になり、神経科学において新しい研究領域が開拓されると考えられます。また、FASHIO-2PMは光学特性が優れているため、神経科学だけでなく免疫、がん、植物など、さまざまな生物分野で利用できます。
さらに、AI技術などの理論研究分野との連携により、脳機能低下や疾患発症の予測、また、逆に得られた知見をAI設計にフィードバックすることで、AI技術のさらなる向上などにも貢献すると期待できます。
論文情報
タイトル
Fast, cell-resolution, contiguous-wide two-photon imaging to reveal functional network architectures across multi-modal cortical areas
著者名
Keisuke Ota, Yasuhiro Oisi, Takayuki Suzuki, Muneki Ikeda, Yoshiki Ito, Tsubasa Ito, Hiroyuki Uwamori, Kenta Kobayashi, Midori Kobayashi, Maya Odagawa, Chie Matsubara, Yoshinori Kuroiwa, Masaru Horikoshi, Junya Matsushita, Hiroyuki Hioki, Masamichi Ohkura, Junichi Nakai, Masafumi Oizumi, Atsushi Miyawaki, Toru Aonishi, Takahiro Ode and Masanori Murayama
雑誌
Neuron
DOI
10.1016/j.neuron.2021.03.032
補足説明
[1] 収差
光学系において、理想的な結像からのずれを意味する。収差が大きいと、観察像にボケやゆがみが生じる。収差には、5種類の単色収差の2種類の色収差がある。
[2] 2光子顕微鏡
近赤外線超短パルスレーザーを用いることで、生体深部にある蛍光分子を観察できる顕微鏡。一つの蛍光分子が二つの光子(近赤外光)を同時に吸収して励起状態となる非線形光学現象を利用している。
[3] スモールワールド性
現実世界の複雑なネットワークに観測されるネットワーク特性の一つ。無作為に選ばれた点が、わずかな数の点を介するだけでつながっている性質を意味する(本研究において点は神経細胞である)。SNSや俳優の共演関係などのさまざまなネットワークで発見されている。
[4] カルシウムイメージング法、カルシウムセンサー
本研究では、細胞内カルシウムイオン(Ca2+)と結合すると蛍光強度が変化するタンパク質(カルシウムセンサー)を神経細胞に発現させ、その蛍光強度の変化を2光子顕微鏡で測定している。計測されるCa2+活動は、神経細胞の活動電位発生に起因している。
[5] 開口数(NA: numerical aperture)
対物レンズの分解能や明るさを示す。基本的に、NAの値が高ければ明るい像が得られるが、収差のある対物レンズではこの限りではない。
[6] ストレール比
実際の光学システム(ここでは対物レンズ)の性能と、回折限界性能との比率(1.0が最大)。ストレール比が0.8より大きいレンズを回折限界、すなわち無収差な対物レンズとして分類される。
[7] 点拡がり関数
光学系における点光源に対する応答関数を意味する。顕微鏡においては、その光学的解像度を定量化するために利用される。シミュレーションに基づき計算することもできるが、アガロース(ゲル化しやすい多糖)に埋め込まれた微小な蛍光ビーズを観察することで実測されることもある。
[8] 信号対雑音比(SN比)
観察しようとしている信号成分(シグナル)と雑音(ノイズ)成分との量の比率。
[9] プリチャープ機構
2光子励起用に近赤外線超短パルスレーザーを用いるが、標本に照射される前にさまざまな光学素子を通過する過程でパルス幅が歪んでしまい、励起光率が低下する。プリチャープ機構はこの歪みを補正する。
[10] 機能的結合強度
本研究では、神経活動から定義された脳領域や神経細胞間の結合強度(相関係数)を意味する。機能的結合強度を求めることで、脳内の情報の流れや同一の情報を処理している脳領域や細胞を同定できる。
発表者・機関窓口
発表者
理化学研究所 脳神経科学研究センター 触知覚生理学研究チーム
チームリーダー 村山 正宜(むらやま まさのり)
機関窓口
理化学研究所 広報室 報道担当E-mail:ex-press“AT”riken.jp
*今般の新型コロナウイルス感染症対策として、理化学研究所では在宅勤務を実施しておりますので、メールにてお問い合わせ願います。
AMED事業に関するお問い合わせ先
国立研究開発法人日本医療研究開発機構
疾患基礎研究事業部疾患基礎研究課
革新的技術による脳機能ネットワークの全容解明プロジェクト
TEL:03-6870-2286 FAX:03-6870-2243
E-mail:brain-m“AT”amed.go.jp
※Emailは上記アドレス“AT”の部分を@に変えてください。
掲載日 令和3年4月20日
最終更新日 令和3年4月20日


