プレスリリース 小児悪性脳腫瘍の進行に関わる新たながんシグナルを発見―がん細胞を増殖させる遺伝子変異の研究が導く新しい治療戦略づくり―
プレスリリース
国立研究開発法人国立精神・神経医療研究センター (NCNP)
ハイデルベルク小児がんセンター(KiTZ)
国立研究開発法人日本医療研究開発機構(AMED)
国立研究開発法人国立精神・神経医療研究センター(NCNP)神経研究所、病態生化学研究部(部長・星野幹雄)の川内大輔室長の研究グループは、「主に大脳皮質に生じる小児悪性脳腫瘍である『テント上上衣腫』において、これまで機能不明であったC11orf95遺伝子が様々な遺伝子と融合することで異常タンパク質の産生をもたらし、腫瘍を発生させる」ことを発見しました。
がんは、遺伝子が何らかの原因で傷つき、機能しなくなったり、正常とは異なる機能を持ったりすることで自分自身の細胞が異常に増殖し始め、様々な組織に機能不全をもたらす疾患です。しかしながら、がんが生じる細胞の起源はさまざまであり、それぞれが同じ遺伝子の傷(変異)で異常増殖を起こすわけではありません。そのため、個々のがんは現在の標準治療である放射線治療や化学療法に対して常に同じ反応を示すわけではなく、より効率的な治療戦略の開発に向け、がんの本態を深く理解することが求められています。
今回、本研究グループは、ドイツがん研究センター、ハイデルベルク大学との国際共同研究により、小児の大脳半球に生じる悪性腫瘍である「テント上上衣腫」で、これまで機能が知られていなかったヒトC11orf95遺伝子が様々な遺伝子と融合した複数の異常遺伝子(C11orf95融合遺伝子)を発見しました。さらにこれらの融合遺伝子が腫瘍形成に与える影響についてモデル動物を作出して解析を行った結果、いずれの融合遺伝子産物も脳に腫瘍を誘発する活性をもつことを明らかにし、そこで働くがんシグナルとして他の脳腫瘍や基底細胞がんで細胞増殖を担う分子であるGLI21)が主要な原因因子であることを突き止めました。更に、腫瘍モデル動物の生体内でGLI2の機能阻害剤として知られる三酸化ヒ素(ATO:製品名トリセノックス)を投与することで、腫瘍進展が抑制される効果が確認されました。これらの結果からC11orf95融合遺伝子をもつ脳腫瘍に対してGLI2の機能を抑制することが、治療に効果的である可能性が証明されました。
本研究では特にC11orf95の機能を分子レベルで初めて解明したことから、C11orf95はZFTA(Zinc Finger Translocation Associated)と改名され、これらの融合遺伝子をもつ上衣腫は最新の世界保健機構(WHO)の病理分類に影響を与え、「C11orf95(ZFTA)融合陽性上衣腫」と命名されることになりました(以降、C11orf95はZFTAと記述します)。このようにグローバルな医学的貢献に加え、将来的には、今回発表したGLI2遺伝子がヒトZFTA融合陽性上衣腫の分子診断マーカーとして役立つだけでなく、有望な治療標的となることが期待されます。
この研究成果は、日本時間2021年4月20日(火)午後13時(報道解禁日時:米国東部標準時(夏時間)2021年4月20日(火)午前0時)に科学誌Cancer Discovery オンライン版に掲載されました。
研究の背景
上衣腫は、小児の大脳半球に生じる難治性の腫瘍です。特にその予後は主に外科的手術の結果に左右されるため、腫瘍に効果的な化学療法が模索されてきましたが、未だがんシグナルに応じた効果的な治療は見つかっていないのが現状です。他の脳腫瘍と同様に十数年前までは見た目(病理学的な解析)からがんの性質や悪性度を評価してきましたが、 近年は見た目に加えて中身(DNAメチル化状態や遺伝子発現など)を詳細に解析することにより、大きく分けて9つのグループに分類できることがわかってきました。そのうち大脳と小脳を分ける硬膜(テント)より上、すなわち主に大脳に生じるRELA2)型とよばれる上衣腫は、テント上上衣腫の約70%を占め、非常に悪性度の高いグループとされています。また、RELA型の腫瘍ではRELA遺伝子がZFTA遺伝子と融合したもの(ZFTA-RELA融合遺伝子)が高頻度で観察され、近年のモデル動物を用いた研究によりこの融合遺伝子の発がん活性が報告されました。このような研究結果をもとに、2016年のWHO病理分類では「RELA融合陽性上衣腫」という分類がなされています。しかし、現在までのDNAメチル化状態を用いた分類でRELA型と診断されていても、実際にはRELA遺伝子が常に陽性というわけではなく、未知の発がんメカニズムの存在が示唆されています。また、ZFTA-RELA融合タンパク質がどのようにがん細胞の増殖を誘導するのか、そのメカニズムには不明な点も多く、治療標的の候補となる分子も十分明らかになっていないのが現状です。そのため、現在の上衣腫の分類だけでは未だ新しい治療法を提案できず、本研究で行われたようなゲノム遺伝学や発生工学を駆使した学際的な研究チームによる、一段と高度な解析が必要とされています。
研究の内容
(1)ヒトRELA型テント上上衣腫において新たな複数の融合遺伝子を発見
まず本国際共同研究チームは、脳腫瘍のDNAメチル化診断とRELA遺伝子の発現の結果が一致しないためにRELA型上衣腫と断定できない脳腫瘍23検体を選び、過去に上衣腫のDNAメチル化分類で報告した501検体と未発表の507検体と合わせてDNAメチル化を基準としたt-SNE3)プロットを行いました。その結果、RELA型上衣腫のグループの周りに4つのサテライトグループが発見され、解析した23検体のうち18検体がこのサテライトグループに属することが明らかになりました(図1A)。特に、これらのサテライトグループ(グループ1~4)はそれぞれ脳腫瘍のDNAメチル化診断の結果において特徴的であり、グループ1は100%、グループ2は約半数の51.1%がRELA型上衣腫と診断されるものの、グループ3、4は上衣腫とは診断されませんでした。次に、これらのサテライトグループがどのような遺伝子を発現しているのかを調べるために、サテライトグループに分類された48検体のRNAシーケンスあるいはDNAパネルシーケンスを行いました。その結果、以前の研究で報告されていたZFTA-RELA融合遺伝子はグループ1と3で確認されました。一方で、グループ2と4ではZFTAがMAML2やMAML3、NCOA1やNCOA2と融合した新しい複数の融合遺伝子が2検体以上で発見されました(図1B、C)。
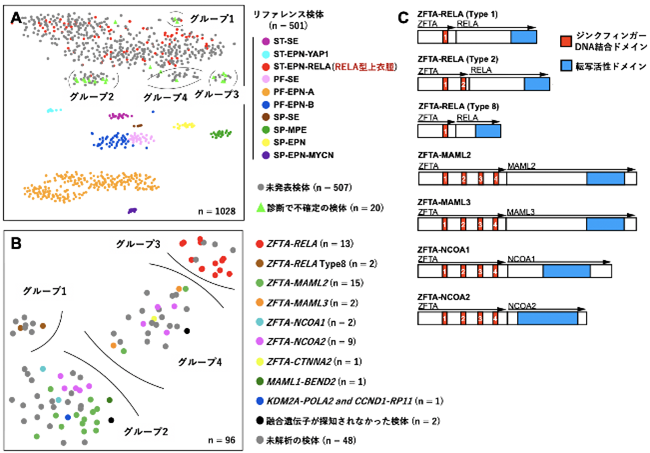
(2)ZFTA融合遺伝子は発達期の脳で発がん誘導活性を持つことを発見
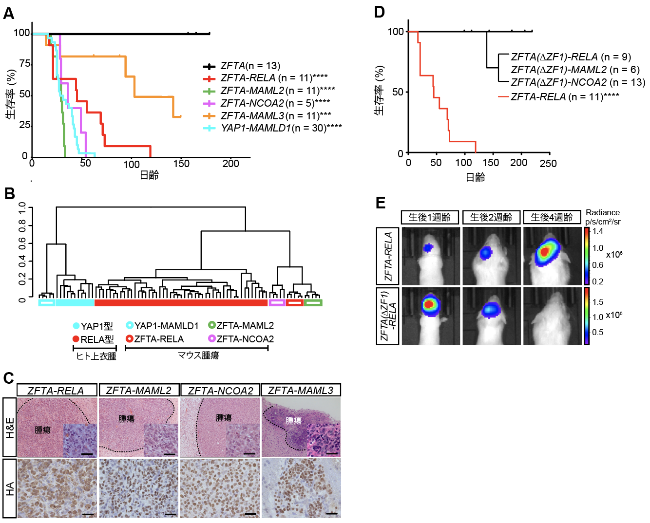
本研究グループを含む過去の研究で、ZFTA-RELA融合遺伝子が単独で>胎仔あるいは新生仔マウスの大脳で発がんを誘導することが知られていました。そこで次に本研究グループは、今回新たに発見されたZFTA融合遺伝子の発がん活性についてモデル動物を用いて調べました。生体内電気穿孔法4)によってZFTA融合遺伝子を胎仔マウスの大脳の神経前駆細胞に導入し、トランスポゾン5)技術を用いて恒常的にZFTA融合タンパク質を作らせた結果、生後数ヶ月以内に見た目がヒト上衣腫と酷似した腫瘍を生みだすことが明らかになりました(図2A)。また、生み出された腫瘍の遺伝子発現パターンについてRNAシーケンスを用いて解析し、ヒト腫瘍のものと比較したところ、ヒトRELA型に近いという結果が得られました(図2B)。次に、ZFTA融合タンパク質の腫瘍細胞内での局在を調べたところ、核内で強いシグナルが観察されました(図2C)。また、いずれの融合タンパク質もZFTAタンパク領域にZinc Finger型DNA結合ドメインをもち、パートナー側に転写活性ドメインを持っていることから、転写活性因子として発がんを誘導する可能性が考えられました。そこでZinc Finger型DNA結合ドメインを欠損したZFTA融合タンパク質を用いたところ、モデル動物において腫瘍形成は認められませんでした(図2D、E)。このことからZFTA融合タンパク質はDNA結合を介して腫瘍を誘導する可能性が示唆されました。
(3)ZFTA融合遺伝子はGLI2を介して腫瘍形成を誘発することを解明
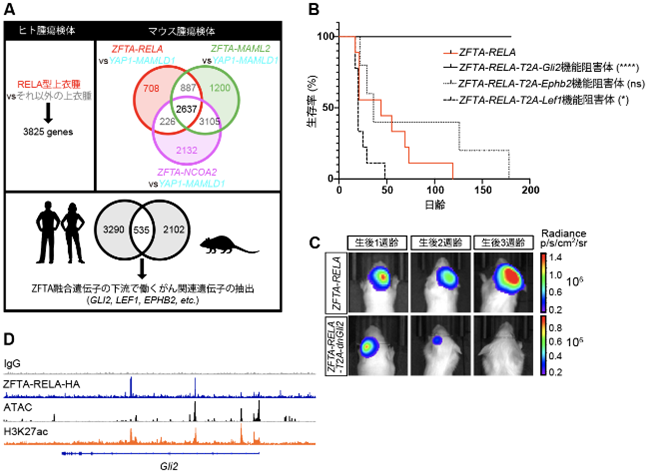
次に本研究グループは、ZFTA融合タンパク質によって転写が活性化される下流の分子シグナルを明らかにするため、ヒト上衣腫のうちRELA型上衣腫において高レベルで存在する3825遺伝子と3つのZFTA融合タンパク質(ZFTA-RELA、ZFTA-MAML2、ZFTA-NCOA2)によってモデル動物の脳に誘導された腫瘍で共通して高レベルで発現する2637遺伝子を比較し、ヒト・マウスの両方の腫瘍において高レベルで発現する535遺伝子を抽出しました。更にこれら535遺伝子を用いた遺伝子オントロジー解析により、がんに深く関わる遺伝子が見出されました(図3A)。次に、これらの遺伝子からZFTA融合遺伝子の下流で腫瘍形成を担う遺伝子の候補として、過去にがん遺伝子として知られるGLI2、LEF1、EPHB2に着目し、その機能阻害体をZFTA融合タンパク質とともにモデル動物の脳細胞に作らせた結果、GLI2の機能阻害体により腫瘍形成が完全に阻害されることが明らかになりました(図3B、C)。またモデル動物の腫瘍を用いたクロマチン免疫沈降法6)により、ZFTA-RELAがGli2遺伝子座で結合していることが明らかになり(図3D)、GLI2はZFTA融合タンパク質の下流で制御され、腫瘍形成の初期段階で必要であることが示唆されました。
(4)GLI2はZFTA融合遺伝子をもつ腫瘍細胞の増殖に不可欠な分子であることを証明
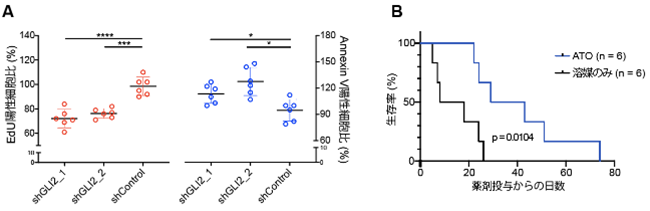
さらに本研究グループはGLI2がZFTA融合遺伝子をもつ腫瘍の治療標的になりうるかどうかを検証するため、腫瘍細胞の増殖がGLI2に依存しているかどうかを調べました。GLI2は遺伝子制御を担うDNA領域である“エンハンサー”に結合して遺伝子のスイッチを制御する転写因子であることに着目し、まず、ヒト上衣腫のうちテント上上衣腫3グループと小脳・後脳部位にできる上衣腫3グループのエンハンサーを抽出し、GLI2タンパク質の結合部位を解析したところ、RELA型上衣腫のエンハンサーでGLI2結合部位が最も高密度で存在することを見出しました。この結果は、GLI2がRELA型上衣腫で様々な遺伝子を制御していることを示しているため、次にヒトRELA型上衣腫の細胞株でGLI2遺伝子の発現量をshRNAを用いたRNA干渉によって減少させたところ、細胞増殖が抑制され、細胞死が促進されました(図4A)。更に、GLI2の機能阻害剤として知られる三酸化ヒ素(ATO)を今回開発したZFTA-RELAモデル動物に投与したところ、寿命が延長する結果が得られました(図4B)。以上の結果から、GLI2がZFTA融合遺伝子をもつ腫瘍にとって重要な分子であることが明らかになりました。
研究の意義と今後の展望
がんの化学療法は、腫瘍細胞が増えるメカニズムに応じて治療薬を使い分ける戦略が効果的であると期待されています。テント上上衣腫の大部分を占めるRELA型は、それらの腫瘍で発見されたZFTA-RELA融合遺伝子の発がんシグナルを担うことが知られているRELAから名付けられました。しかし、本研究では世界最大規模の上衣腫検体を用いることにより、ZFTA-RELA融合遺伝子に加えて新たに複数のZFTA融合遺伝子を同定し、その発がん性を示しただけでなく、ZFTA融合遺伝子産物がZFTAタンパク質領域に含まれるDNA結合領域を介して、その下流でがんシグナルを活性化することを証明しました。更に、ZFTA融合遺伝子に共通したがんシグナルエフェクターとしてGLI2を同定することに成功し、上衣腫治療のための標的候補となる可能性を示しました。これらの結果は、最新のヒト上衣腫のWHO病理分類において、これまでの「RELA融合陽性上衣腫」という分子分類から、RELA融合パートナーのZFTAに着目した「ZFTA融合陽性上衣腫」という分子分類に変更された点から鑑みても、医学的見地から非常に大きな意義があります。今回の研究成果は、上衣腫の治療法を検討する際の分子診断マーカーとしてだけでなく、ZFTA融合陽性上衣腫の増殖を制御するメカニズムを探る発展的医療研究の基盤となることが期待されます。
用語解説
- 1)GLI2
- アミノ基側に転写抑制ドメイン、カルボキシル基側に転写活性ドメインをもち、ジンクフィンガー型DNA結合ドメインを介して細胞増殖に関わる遺伝子を制御するGLIファミリーに属する分子量約170kDaの転写因子。GLIファミリーは細胞増殖シグナルであるソニックヘッジホッグ経路の下流にあるエフェクター分子であり、髄芽腫や基底細胞がんなどの悪性腫瘍において遺伝子の増幅や転写産物の上昇が報告されている。
- 2)RELA(p65)
- がんや炎症、自己免疫疾患などに関わるNF-KBファミリー複合体のクラスIIサブユニットの一つである分子量65kDaの核タンパク質。アミノ基側にDNA結合ドメイン、カルボキシル基側に転写活性ドメインを持ち、別のサブユニットとヘテロ二量体を形成して遺伝子発現の亢進に関与している。
- 3)t-SNE
- 高次元のデータを低次元(主に二次元)に削減し可視化するためのアルゴリズム。この手法により、複雑なDNAメチル化解析のパラメータを二次元に落とし込み、いくつかの意味のある集団に分ける(クラスタリングする)ことが可能になる。最近では単一細胞RNAシーケンスなどの解析にも使用され、性質の酷似した細胞集団を二次元で表現することができる。
- 4)生体内電気穿孔法
- 電気パルスを用いて細胞膜の透過性をあげることにより、DNAやRNAなどの分子を生体内の細胞に導入する方法。高効率に遺伝子導入が可能である一方で、適用できる組織や時期が限定される。本研究では目的のDNAをマウス胎仔脳室に注入し、複数回の矩形波電気パルスを用いて、大脳の脳室帯に存在する神経幹細胞・前駆細胞に遺伝子を導入している。
- 5)トランスポゾン
- ゲノム上を動くことが可能なDNAで、その両端に転移を起こす酵素(転移酵素)によって認識されるための配列をもつ。本研究では目的の遺伝子の両側に転移酵素が認識する配列を挿入したDNAと転移酵素を同時に細胞内に導入することで、転移酵素がDNAを切り出し、細胞のゲノムに挿入することが可能になる。このトランスポゾン技術により目的の遺伝子を他の細胞のゲノム に挿入することが極めて容易になった。
- 6)クロマチン免疫沈降法(ChIP)
- 目的のタンパク質がゲノムの特定の領域に結合しているかどうかについて抗体を用いて検証する方法。最近では、ゲノムワイドな解析を行うために次世代シーケンスと組み合わせたChIPシーケンスがポピュラーである。
原論文情報
- 論文名
- Cross-species genomics reveals oncogenic dependencies in ZFTA/C11orf95 fusion-positive supratentorial ependyomomas
- 著者
- Tuyu Zheng, David R. Ghasemi, Konstantin Okonechnikov, Andrey Korshunov, Martin Sill, Kendra K. Maass, Patricia Benites Goncalves da Silva, Marina Ryzhova, Johannes Gojo, Damian Stichel, Amir Arabzade, Robert Kupp, Julia Benzel, Shinichiro Taya, Toma Adachi, Ryo Shiraishi, Nicolas U. Gerber, Dominik Sturm, Jonas Ecker, Philipp Sievers, Florian Selt, Rebecca Chapman, Christine Haberler, Dominique Figarella-Branger, Guido Reifenberger, Gudrun Fleischhack, Stefan Rutkowski, Andrew M. Donson, Vijay Ramaswamy, David Capper, David W. Ellison, Christel C. Herold-Mende, Ulrich Schüller, Sebastian Brandner, Pablo Hernáiz Driever, Johan M. Kros, Matija Snuderl, Till Milde, Richard G. Grundy, Mikio Hoshino, Stephen C. Mack, Richard J. Gilbertson, David T.W. Jones, Marcel Kool, Andreas von Deimling, Stefan M. Pfister, Felix Sahm, Daisuke Kawauchi, Kristian W. Pajtler
- 掲載雑誌
- Cancer Discovery
- DOI
- 10.1158/2159-8290.CD-20-0963
- URL
- https://cancerdiscovery.aacrjournals.org/content/early/2021/04/20/2159-8290.CD-20-0963
助成金
本研究成果は、以下の事業・研究領域・研究課題によって行われました。
- JSPS国際共同研究加速基金・帰国発展研究 (19K24687)
- 国立研究開発法人 日本医療研究開発機構(AMED)革新的がん医療実用化研究事業(JP20ck0106534)
お問い合わせ先
研究に関するお問い合わせ
川内 大輔
国立精神・神経医療研究センター神経研究所 病態生化学研究部
住所:〒187-8553 東京都小平市小川東町4-1-1
Tel:042-346-1722 Fax:042-346-1725
E-mail:d. kawauchi(a)ncnp.go.jp
報道に関するお問い合わせ
国立研究開発法人 国立精神・神経医療研究センター
総務課広報係
〒187-8553 東京都小平市小川東町 4-1-1
Tel:042-341-2711(代表) Fax:042-344-6745
Email:ncnp-kouhou(a)ncnp.go.jp
AMEDに関するお問い合わせ
国立研究開発法人 日本医療研究開発機構 (AMED)
疾患基礎研究事業部 疾患基礎研究課
革新的がん医療実用化研究事業 事務局
〒100-0004 東京都千代田区大手町 1-7-1 読売新聞ビル22F
Tel:03-6870-2286 Fax: 03-6870-2243
Email: cancer(a)amed.go.jp
※E-mailは上記アドレス(a)の部分を@に変えてください。
関連リンク
掲載日 令和3年4月22日
最終更新日 令和3年4月22日


