神経ネットワークの要の構造、シナプスを強化する新しい仕組みを解明―認知症等の神経疾患解明への応用に期待―
プレスリリース
国立大学法人奈良先端科学技術大学院大学
国立研究開発法人日本医療研究開発機構
概要
奈良先端科学技術大学院大学(奈良先端大、学長:塩崎一裕)先端科学技術研究科バイオサイエンス領域の稲垣直之教授、Ria Kastian(リア・カスティアン)博士研究員、嶺岸卓徳助教、京都大学大学院医学研究科の林康紀教授らのグループは、脳内の情報伝達を担う神経ネットワークのシナプスを強化する新しい仕組みを明らかにしました。
ヒトの脳内では、膨大な数の神経細胞が神経ネットワークを形成し、生きるために必要な知覚、運動、記憶・学習などの脳の高次機能活動を支えています。神経細胞は、情報(神経伝達物質)を出力する軸索とこれを受け取る樹状突起の間に形成されるシナプスを介して神経細胞間の情報伝達を行います。
例えば、脳内で記憶を司る海馬では、樹状突起上に1万個近く存在するスパインと呼ばれる小さなトゲ状構造体が他の神経細胞の軸索とシナプスを形成します。樹状突起スパインは、神経活動により軸索から放出される神経伝達物質に応答して大きさが変化しますが、その大きさの拡大は、シナプスにおける情報伝達を強化すると考えられています。このシナプスの強化は、ヒトの記憶や学習に必要な脳内の神経ネットワークの変化に重要な役割を果たし、神経回路を模したニューラルネットワークに基づく人工知能(AI)の学習でも用いられています。また、神経活動に応答したスパイン調節機構の異常は、認知症や自閉症、知的障害などの神経疾患の発症と関連することが示唆されて来ました。しかし、これまで樹状突起スパインの大きさを調節する仕組みはよくわかっていませんでした。
今回、研究グループは、シューティンという細胞内タンパク質が海馬神経細胞の樹状突起スパインの形成や、神経活動に応答したスパインの拡大を行うことを見出しました。また、その仕組みとして、シューティンが細胞の骨格を形作るアクチン線維と細胞膜上の細胞接着分子を連結することでスパインの拡大に必要な力を生み出すことを解明しました。
本研究の成果により、神経ネットワークの形成や記憶・学習、ヒトの神経疾患についての分子レベルの理解が深まるとともに、医療への応用などが期待できます。この研究成果は令和3年5月18日(火)午前11時(EST)に米国科学雑誌Cell Reportsに掲載されます。
解説
研究の背景と経緯
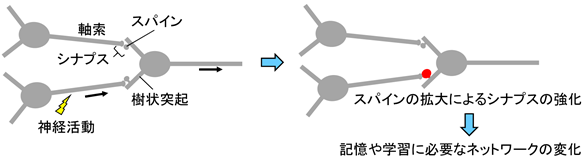
ヒトの脳内では、膨大な数の神経細胞が神経ネットワークを形成し、生きるために必要な知覚、運動、記憶・学習などの脳の高次機能活動を支えています。神経細胞は、軸索と樹状突起の間のシナプス1)を介して神経細胞間の情報伝達を行います。例えば、脳内で記憶を司る海馬2)では、樹状突起上に存在するスパインと呼ばれる小さなとげ状の構造体と他の神経細胞の軸索が連結してシナプスを形成します(図1左)。このようなシナプスの構成単位である樹状突起スパイン3)は、1個の神経細胞あたり1万個存在し、ヒトの大脳には100兆個ものスパインが存在するといわれています。
樹状突起スパインは、神経活動により軸索から放出される神経伝達物質に応答してダイナミックに数や大きさが変化しますが、その数の増加はシナプスの数の増加を引き起こし、その大きさの拡大はシナプスの強化を引き起こすと考えられています(図1右)。このシナプスの強化は、私たちの記憶や学習に必要な脳内の神経ネットワークの変化に重要な役割を果たします(図1)。また、シナプスの強化は、神経回路を模したニューラルネットワークに基づく人工知能(AI)の学習でも用いられています。
また、神経活動に応答したスパイン調節機構の異常は、認知症や自閉症、知的障害などの神経疾患の発症と関連することが示唆されてきました。例えば、認知症や知的障害の患者の脳では、スパインの数が減少し、自閉症の脳ではスパインの数が増加することが報告されています。しかし、これまで樹状突起スパインのサイズを調節する仕組みはよくわかっていませんでした。
研究の内容
稲垣教授らの研究グループは、以前に脳に存在するシューティン4)というタンパク質を発見しており、これまでの研究から、シューティンが神経ネットワーク形成に関わる軸索伸長の方向決定や、神経細胞の移動などに関わることがわかっています。今回、研究グループは、シューティンが海馬の神経細胞の樹状突起スパインに存在することを見出しました。そこで、シューティンを遺伝的に作れないノックアウトマウスを作製して海馬神経細胞の樹状突起スパインを調べたところ、その数が減少することがわかりました(図2A)。一方、シューティンの量を増やすと、スパインの数も増えました(図2B)。さらに、図3Aの上段に示すように、スパインを興奮性の神経伝達物質であるグルタミン酸の局所的投与により30秒間刺激すると(赤色の*)スパインの拡大が30分以上続きましたが(矢頭)、シューティンの量を減少させると、スパインの拡大が大きく抑制されました(図3A中段及びB)。さらに、そこにシューティンを戻すとスパインの拡大が回復しました(図3A下段矢頭及びB)。以上の結果から、シューティンがスパインの形成やグルタミン酸刺激によって引き起こされるスパイン拡大に必要とされることがわかりました。
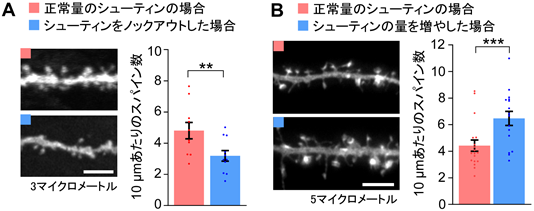
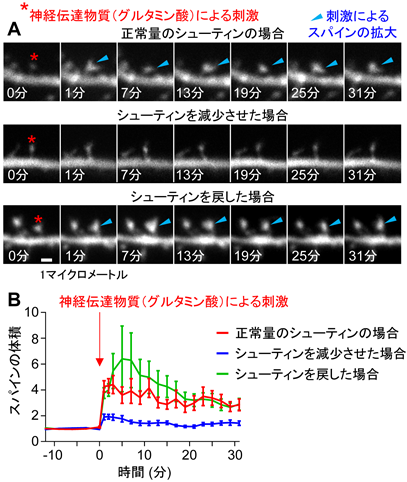
B.樹状突起スパインの大きさの変化を示すグラフ。
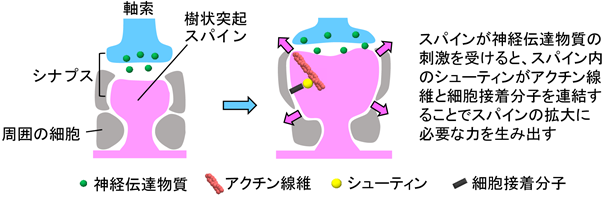
さらに、シューティンがどのようにして樹状突起スパインを拡大するのか、その仕組みを調べたところ、樹状突起スパインがグルタミン酸により刺激を受けるとシグナル伝達によりスパイン内のシューティンが活性化されることがわかりました。そして、活性化したシューティンがスパイン内の細胞骨格であるアクチン線維5)と細胞膜上の細胞接着分子6)(カドヘリンとL1-CAM)を連結することによりスパインの拡大に必要な力を生み出すことが明らかとなりました(図4)。
今後の展開
今回の研究は、神経ネットワークのシナプスを調節する樹状突起スパインの形成と拡大の仕組みを分子レベルで解明した点に意義があります。最近になり、海外の研究グループにより、知的障害の家系で発現量が大きく減少する遺伝子の一つとしてシューティンが報告されました。認知症や知的障害の患者の脳では、樹状突起スパインの数が減少し、自閉症の脳ではスパインの数が増加することが報告されているため、シューティンの分子調節機構の破綻が樹状突起スパインの形成とサイズ増大に障害を起こすことでこれらの病気の一因となる可能性が考えられます。また、1)シューティンの量を減少させると樹状突起スパインの数が減少し、逆に増加させるとスパインの数も増加すること、さらに、2)シューティンの量を減少させると神経伝達物質によるスパインの拡大が抑制され、そこにシューティンを補充するとスパインの拡大が回復することから、今回の研究成果が端緒となり、樹状突起スパインの数や大きさの調節を基盤とした医療分野での応用研究の推進につながることが期待できます。
本研究は、国立研究開発法人日本医療研究開発機構(AMED)の革新的先端研究開発支援事業(AMED-CREST)「メカノバイオロジー機構の解明による革新的医療機器及び医療技術の創出」研究開発領域における研究開発課題「細胞-基質間の力を基盤とした細胞移動と神経回路形成機構の解明およびその破綻による病態の解明」(研究開発代表者:稲垣直之)および日本学術振興会(JSPS)科学研究費、大阪難病研究財団、戦略的創造研究推進事業(JST-CREST)、ヒューマン・フロンティア・サイエンス・プログラム(HFSP)による支援によって実施しました。
用語解説
- 1)シナプス
- 神経細胞の情報を出力する軸索終末と情報を受け取る樹状突起や細胞体との間に形成される接触構造。神経活動によりシナプス前部の軸索終末から放出される神経伝達物質は、シナプス後部の樹状突起や細胞体にある受容体を活性化させることでシグナルを伝える。
- 2)海馬
- 大脳皮質の内側に存在する、記憶や学習に重要な役割を果たす領域。
- 3)樹状突起スパイン
- 神経細胞の樹状突起上に存在する0.5―2マイクロメートル程度の大きさのトゲ上の構造体。興奮性の軸索は樹状突起上のスパインとシナプスを形成する(図1左)。樹状突起スパインは、1個の神経細胞あたり約1万個存在し、私たちの大脳には100兆個ものスパインが存在するといわれている。神経伝達物質によって刺激を受けた樹状突起スパイン内では、シグナル伝達が起こる。また、シグナル伝達によりスパインの数や大きさはダイナミックに変化し、その拡大はシナプスの強化を引き起こすと考えられている。
- 4)シューティン
- 脳に存在するタンパク質で、これまでの研究から、神経ネットワーク形成に関わる軸索伸長の方向決定(軸索ガイダンス)や、神経細胞の移動などに関わることが知られている。
- 5)アクチン線維
- 細胞内に存在するアクチンタンパク質が線維上に連結(重合)することで形成される。筋肉の収縮や細胞の形態変化などに関わることが知られている。
- 6)細胞接着分子
- 細胞膜に存在して細胞同士や細胞と細胞外の物質(細胞外基質)を接着させる分子。
お問い合わせ先
研究に関する事
奈良先端科学技術大学院大学 先端科学技術研究科 バイオサイエンス領域
神経システム生物学研究室 稲垣直之
TEL:0743-72-5466 FAX:0743-72-5651
E-mail:ninagaki“AT”bs.naist.jp
報道に関する事
奈良先端科学技術大学院大学 企画総務課 渉外企画係
TEL:0743-72-5026 FAX:0743-72-5011
E-mail:s-kikaku“AT”ad.naist.jp
AMED事業に関する事
国立研究開発法人日本医療研究開発機構(AMED)基盤研究事業部 研究企画課
TEL:03-6870-2224 FAX:03-6870-2246
E-mail:kenkyuk-ask“AT”amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
関連リンク
掲載日 令和3年5月20日
最終更新日 令和3年5月20日


