プレスリリース ヒト希少遺伝疾患「NGLY1欠損症」発症機構の解明―治療法開発への第一歩―
プレスリリース
東京都医学総合研究所
理化学研究所
タケダ-CiRA共同研究プログラム
日本医療研究開発機構
公益財団法人東京都医学総合研究所ユビキチンプロジェクトの吉田雪子主席研究員・松田憲之プロジェクトリーダー、田中啓二理事長らは、京都大学 岩井一宏教授、理化学研究所開拓研究本部鈴木糖鎖代謝生化学研究室の鈴木匡主任研究員(T-CiRA PI-兼任)、武田薬品工業株式会社リサーチ、T-CiRAディスカバリー 朝比奈誠主任研究員・兎澤隆一主席研究員らと共同で、ヒト希少遺伝疾患「NGLY1欠損症」の発症メカニズムを提唱しました。本研究成果は、「NGLY1欠損症」の治療法の開発につながるものと期待できます。
この研究成果は2021年7月6日(火)4時(日本時間)に米国科学誌「PNAS」のオンライン版に掲載されました。
発表のポイント
- これまで発症のメカニズムがわからず、治療法もなかった重篤な希少遺伝疾患NGLY1欠損症の発症メカニズムを解明した。
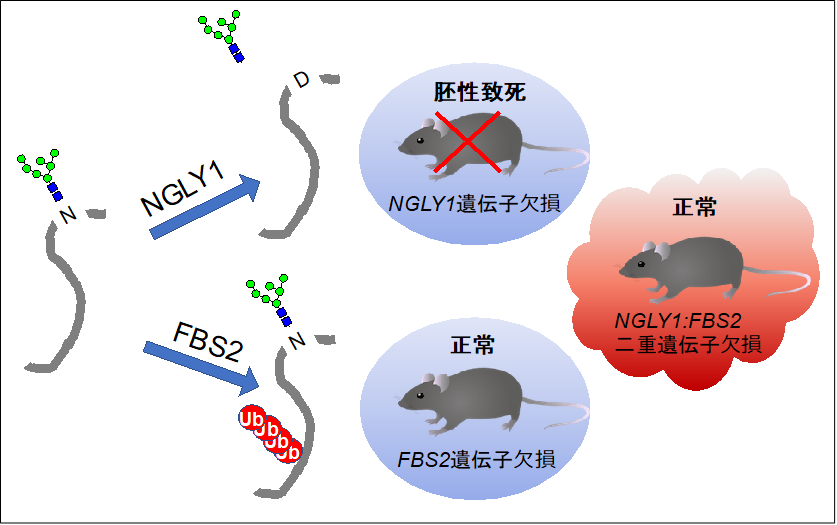
- 糖タンパク質からN型糖鎖を外す酵素NGLY1の遺伝子破壊マウスは、発生期に異常が生じ生まれてこない。しかし、このNGLY1遺伝子と、糖鎖を認識してユビキチン鎖を付加する酵素FBS2の遺伝子を同時に破壊した二重変異マウスは、正常に発育することを見出した。
- NGLY1が作れない細胞にFBS2を発現させると、分解シグナルであるユビキチン鎖がついたままの異常な糖タンパク質が細胞中に溜まり、細胞死を起こすことがわかった。
- 細胞の中に蓄積した異常なユビキチン化糖タンパク質は、生命の維持に必須なタンパク質分解装置プロテアソームの機能不全を誘発することを発見した。
研究の背景
NGLY1(細胞質ペプチド:N−グリカナーゼ)は、細胞質内でタンパク質のN型糖鎖(注1)を根元から切断する酵素で、私達の身体の中で間違って合成され、構造が異常になったタンパク質のクリアランスに関わっています(注2)。2012年、エクソーム分析によってNGLY1欠損症の患者が海外で発見されました。NGLY1欠損症は、発育不全、四肢の筋力低下、不随意運動、てんかん、脳波異常、無涙症、新生児の肝機能障害等を引き起こす重篤な疾患です。NGLY1欠損症の娘をもった両親が設立したGrace Science財団(https://gracescience.org/)が積極的に治療法開発を支援し、世界中で研究が加速しているにもかかわらず、未だ発症の詳細なメカニズムや治療法の開発は道半ばです。理化学研究所・T-CiRAでは、NGLY1欠損症の治療法の開発を目指し、これまでに患者の症状と類似した表現型を示す動物モデルを開発してきました。その中で、研究に汎用されるB6というマウス系統においては、NGLY1遺伝子を欠損すると胚性致死であることを報告しています。
研究の内容
N型糖鎖を持つ糖タンパク質の糖鎖は、一般的には細胞の外側、あるいは細胞内小器官の膜の内側を向いているため、細胞質側には存在しませんが、細胞質には、脱糖鎖酵素NGLY1と共に糖鎖に結合して、プロテアソームによる分解を引き起こすシグナルとなるユビキチン鎖(注3)をつける酵素が複数存在します(図1)。本研究グループは、NGLY1遺伝子欠損B6マウスにおいて、この糖鎖認識ユビキチン付加酵素(注4)のひとつであるFBS2の遺伝子も同時に欠損させることで、胚性致死を回復させ、ほぼ正常に生育することを見出しました(図2)。つまり、FBS2が、NGLY1のない状態では生体に異常を引き起こす可能性があると考えました。
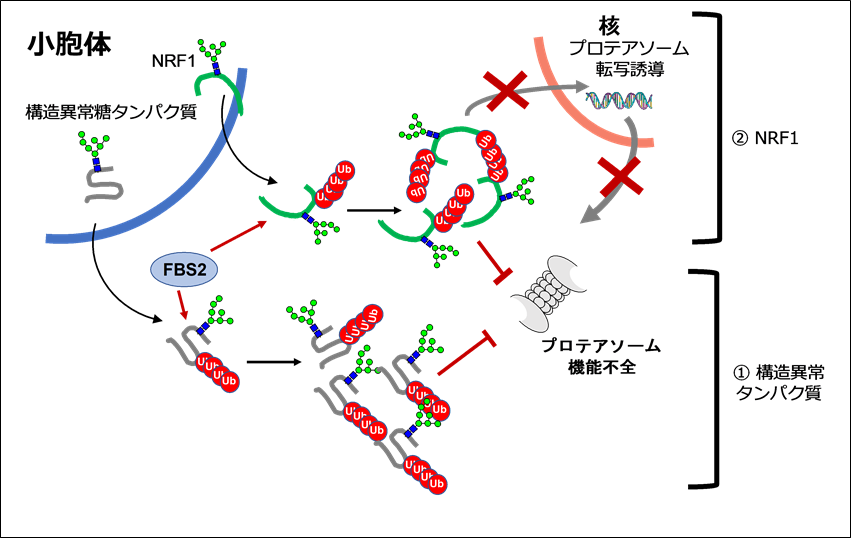
次に、この仮説が正しいかを調べるために、NGLY1遺伝子を破壊した培養細胞にFBS2を発現させたところ、細胞が増殖せず、そのうち細胞死を起こすことを見出しました。詳細に解析すると、NGLY1がない細胞でFBS2が働くと、分解シグナルであるはずのユビキチン鎖が異常についた糖タンパク質が細胞に溜まってしまい、プロテアソームの機能が落ちてしまうことがわかりました。プロテアソームは、細胞の増殖や恒常性の維持に欠かせない分解装置であり、うまく働かなくなると細胞は死んでしまいます。細胞にはプロテアソームの活性を維持する機構があり、プロテアソームは活性が低下すると、NRF1(注5)という転写因子により新たなプロテアソームが作られるようになりますが、FBS2がNRF1を異常にユビキチン化することで、プロテアソームの活性回復機能を損なうことも明らかになりました(図3)。
胚性致死のNGLY1遺伝子欠損マウスの組織中では、NRF1のユビキチン化が認められましたが、NGLY1/FBS2の二重遺伝子欠損マウスではユビキチン化がみられないことからも、生体内でも同じようにプロテアソーム活性の低下が致死性を引き起こしている可能性が考えられます。
社会的意義・今後の展望
本研究では、NGLY1欠損症の発症メカニズムを明らかにしました。FBS2遺伝子欠損マウスは異常な表現型がなく、NGLY1がない場合にFBS2が働くことが生体に悪影響を及ぼすと考えられることから、FBS2の活性を特異的に抑制することは、NGLY1欠損症の治療につながる可能性があります。そのため、本研究で得られたマウスの知見がヒトにおいても同様であるかを、今後研究を進めていく予定です。
用語解説
- (注1)N型糖鎖
- タンパク質を修飾する糖鎖には結合様式によりN型(アスパラギンの側鎖のアミノ基に結合)とO型(セリンやトレオニンの側鎖の水酸基に結合)のものがあります。N型糖鎖をもつ糖タンパク質糖鎖は一般的に細胞の外に存在し、細胞質には存在することは稀です。
- (注2)異常タンパク質クリアランス機構
- 糖タンパク質は小胞体という細胞内小器官で糖鎖がつけられて、立体構造が形成されていきますが、正しい構造をとれなかったものは、細胞質にあるプロテアソームという巨大複合体で分解されるという恒常性維持の機構が知られています。プロテアソームが詰まらないようにNGLY1により糖鎖が外されると考えられています。専門的には「小胞体関連分解」と呼ばれます。
- (注3)ユビキチン
- 76個のアミノ酸からなる小さなタンパク質ユビキチンは、酵母からヒトまで全ての真核生物で保存されています。鎖状に連なったユビキチン鎖は、プロテアソームによる分解の目印として機能します。
- (注4)ユビキチン付加酵素
- ユビキチンは、ヒトでは数百種類存在するユビキチン付加酵素(ユビキチンリガーゼ)がタンパク質の修飾や構造を見分けて付けられます。N型糖鎖をシグナルとしてユビキチンを付加する酵素は3種類あります。
- (注5)NRF1
- 小胞体に存在するN型糖タンパク質。常にプロテアソームにより分解を受けていて、通常は、殆ど細胞内に存在しません。しかし、プロテアソームの活性が弱まると、分解が抑えられて、核へ移動し、プロテアソームの合成を誘導する転写因子として働くようになります。
- (注6)デアミダーゼ
- アスパラギンやグルタミンなどの酸アミドを加水分解する酵素の総称。
アスパラギン + H2O → アスパラギン酸 + NH3
グルタミン + H2O → グルタミン酸 + NH3
本研究の主な助成事業
日本医療研究開発機構(AMED)の革新的先端研究開発支援事業(AMED-CREST)「プロテオスタシスの理解と革新的医療の創出」研究開発領域における研究開発課題「細胞質における糖鎖生物学―細胞恒常性維持の包括的理解を目指して」(研究開発代表者:鈴木匡)(20gm1410003)、日本学術振興会(JSPS)科学研究費補助金などの支援を受けておこなわれました。
論文情報
- 論文名
- Loss of peptide:N-glycanase causes proteasome dysfunction mediated by a sugar-recognizing ubiquitin ligase
(ペプチドNグリカナーゼの欠損は糖鎖認識ユビキチンリガーゼを介してプロテアソームの機能不全を引き起こす) - 発表雑誌
- Proceedings of the National Academy of Science of the United States of America(PNAS)
- DOI
- 10.1073/pnas.2102902118
- URL
- https://www.pnas.org/content/118/27/e2102902118
お問い合わせ先
研究に関すること
ユビキチンプロジェクト 吉田 雪子 主席研究員
電話:03-5316-3123(内線2221)
メールアドレス:yoshida-yk“AT”igakuken.or.jp
東京都医学総合研究所に関すること
事務局研究推進課:武仲・大井
電話:03-5316-3109
理化学研究所に関すること
理化学研究所広報室報道担当
メールアドレス:ex-press“AT”riken.jp
T-CiRAに関すること
武田薬品工業 リサーチT-CiRAディスカバリー
メールアドレス:T_CiRA“AT”takeda.co.jp
AMEDに関すること
国立研究開発法人日本医療研究開発機構(AMED)
シーズ開発・研究基盤事業部 革新的先端研究開発課
メールアドレス:kenkyuk-ask“AT”amed.go.jp
※メールアドレスは上記アドレス“AT”の部分を@に変えてください。
関連リンク
掲載日 令和3年7月5日
最終更新日 令和3年7月5日


