プレスリリース 低ホスファターゼ症小児患者を対象とした高純度間葉系幹細胞(REC-01)移植の治験開始
プレスリリース
島根大学医学部附属病院
日本医療研究開発機構
島根大学(学長:服部泰直)医学部附属病院(病院長:椎名浩昭、島根県出雲市)は、同大学医学部小児科の竹谷健教授らを責任医師とする研究グループによって、生まれつき骨形成が困難な難病である低ホスファターゼ症小児患者を対象に、骨分化能が高い高純度間葉系幹細胞*1・2製剤(REC-01)を移植する新しい治療法について安全性、有効性を評価する医師主導治験*3を開始します。
本治験の背景
低ホスファターゼ症は、生まれつき骨の形成に必要な酵素(アルカリホスファターゼ)が少ないため、骨が硬くならないこと(石灰化障害)による骨の湾曲、易骨折性、歯の脱落等が確認されるだけでなく、中枢神経症状として、けいれんや難聴、発達遅滞を生じます。特に肋骨をはじめとする胸郭の低形成による呼吸障害がある場合、生命予後が不良で、最も重症な周産期に発症する患者の死亡率はほぼ100%です。現状国内患者数は100~200人とされ、国から難病指定を受けています。
現在、この難病に対しては骨の石灰化を改善させる酵素補充療法がありますが、生涯に渡って定期的に投与する(週1~3回皮下注射)必要があること、酵素に対する抗体が産生されて効果が減弱すること、脳血液関門を通らないため中枢神経系症状は改善しないこと、医療費が高額であること(最低でも年間2,000万円以上)などの問題点があります。このため、骨形成をはじめとする症状改善効果が高く、効果が持続する治療方法(根治療法)が必要とされています。
今回治験責任医師となる竹谷教授らは、文部科学省・再生医療の実現化プロジェクト(2008~2012年度)及び厚生労働省・厚生労働科学研究費補助金(再生医療実用化研究事業)(2011~2013年)の支援を得て、低ホスファターゼ症に対するヒト幹細胞を用いた臨床研究を行い、間葉系幹細胞の移植により、世界で初めて全身骨の再生に成功し、救命させることができました[図1]。しかし、同臨床研究で実施された症例では、残念ながら、骨構造が正常レベルに達するまでの改善には至りませんでした。
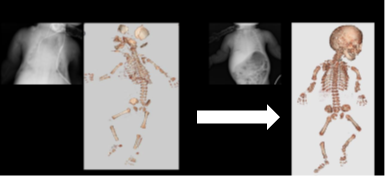
(Taketani et al. Cell Transplantation 2015.)
一方、島根大学医学部生命科学講座の松崎有未教授らは、ヒト骨髄液から、極めて純度の高い間葉系幹細胞を分離する技術を開発し、この技術で選別された増殖能・分化能の高い高純度間葉系幹細胞(REC)*2を骨形成不全に適用することを目指し、同大学発バイオベンチャーPuREC(株)を設立しました。
竹谷教授は、このRECを使用して改めて低ホスファターゼ症を治療することを企図し、2017年よりAMEDの「橋渡し研究戦略的推進プログラム・シーズB」の助成を受けて非臨床研究を進め、安全性の確認を行うと同時に、RECの生体内での生着による骨の形成に必要な酵素(アルカリホスファターゼ)の産生、さらには骨分化をも確認することで、本治験の有効性の示唆を得ることができました。
この結果を受け、今回島根大学医学部附属病院は、低ホスファターゼ症の根治療法の実現に向けて、REC-01移植の安全性および有効性を評価するための医師主導治験を行います。
本治験はAMEDの「再生医療実用化研究事業」の支援の下、岡山大学新医療研究開発センターの協力により実施され、治験で用いるREC-01は、PuREC(株)と(株)ジャパン・ティッシュ・エンジニアリングから提供されます。
用語解説
- *1 間葉系幹細胞
- 再生医療応用が期待される3種の幹細胞としては、受精卵から得られる胚性幹細胞(ES細胞)、皮膚線維芽細胞などから人工的に複数の遺伝子を導入して得られるiPS細胞、および生体内の組織、臓器に存在する体性幹細胞があります。現在、これらを用いた創薬・臨床応用が世界中で盛んに研究開発されています。間葉系幹細胞(Mesenchymal Stem Cell, MSC)は体性幹細胞の1種です。主に骨髄に存在し、骨、軟骨の再生等に関与しています。
- *2 「高純度間葉系幹細胞」REC(Rapidly Expanding Cells)
- PuREC株式会社の創業者、松崎らの開発したヒト骨髄由来間葉系幹細胞です。松崎らは、LNGFR(CD271)Thy1(CD90)の2種の細胞表面のマーカーを認識する抗体を用いることで極めて効率よくヒトMSCを選別することができることを明らかにし、ヒト骨髄液などからセルソーターを用いて高純度なヒト間葉系幹細胞(REC)を分離する技術を開発しました。RECは従来方法で分離したMSCと比較し、A)均一な細胞集団である、B)細胞老化を示していない、C)細胞の大部分が増殖期にある、D)高い分化能(含、骨分化能)を示す、E)遊走性を示すといった特徴を有しています。(Mabuchi et al. Stem Cell Reports 2013)
- *3 医師主導治験
- 国から医薬品、医療機器、再生医療等製品として承認を得るために、安全性と有効性を確認する臨床試験を「治験」といい、医師自ら企画・立案して行う治験のことを「医師主導治験」といいます。
本治験の概要
- 治験製品
- REC-01(高純度間葉系幹細胞)
- 対象
- 低ホスファターゼ症
- 目的
- REC-01の安全性、生着率、全身骨の成長状況、ならびにバイオマーカーの検討
- デザイン
- 第I/IIa相試験(First in Human試験):非盲検・非対照試験
- 計画症例数
- 3例
- 登録期間
- 2021年7月~2022年9月(但し、3例目の投与確定まで)
- 治験責任医師
- 島根大学医学部・小児科 竹谷 健
お問い合わせ先
治験について
島根大学医学部附属病院 治験事務局 小田泰昭
TEL:0853-20-2220
E-mail:y-oda“AT”med.shimane-u.ac.jp
報道について
島根大学医学部附属病院 総務課企画調査係
TEL:0853-20-2018(代表)
E-mail:mga-kikaku“AT”office.shimane-u.ac.jp
AMED事業について
国立研究開発法人日本医療研究開発機構
再生・細胞医療・遺伝子治療事業部 再生医療研究開発課
TEL:03-6870-2220
E-mail:saisei”AT”amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
関連リンク
掲載日 令和3年7月15日
最終更新日 令和3年7月15日


