プレスリリース 骨肉腫の肺転移機構を解明し、転移阻害薬候補を発見
プレスリリース
がん研究会
日本医療研究開発機構
ポイント
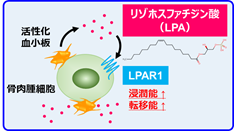
- 骨肉腫細胞は、血流中で血小板と接触することで血小板を活性化し、活性化血小板(※1)から産生・放出されるリゾホスファチジン酸(LPA(※2))を介して浸潤能を亢進することを明らかにしました。
- 骨肉腫細胞ではLPA受容体LPAR1が高発現しており、血小板依存的な骨肉腫の浸潤能亢進に必須であることを、マウス肺転移モデルを用いて明らかにしました。
- LPAR1アンタゴニスト(※3)の投与により、骨肉腫の肺転移を抑制できる可能性を示しました。
概要
がん研究会がん化学療法センター基礎研究部の高木聡研究員、片山量平部長らの研究グループは、骨肉腫細胞が血小板を巧みに利用することで肺転移を促進することを明らかにしました(図1)。
本研究成果から、LPAR1を標的とした薬剤が、肺転移を抑制することで骨肉腫の予後改善に貢献できる可能性が、実験的に示されました。
骨肉腫は、小児や若年者を好発年齢とする希少がんであり、肺転移が予後不良因子です。したがって、骨肉腫治療において肺転移を抑制することは、予後の改善にとって重要な課題ですが、骨肉腫のような希少がんの転移機構については不明な点が多く残されています。今回、研究グループは、骨肉腫細胞に共通する特徴として、高い血小板活性化能を持つことを見出し、活性化された血小板から産生・放出されるリゾホスファチジン酸(LPA)が骨肉腫の浸潤能を亢進することを突き止めました。また、骨肉腫細胞ではLPA受容体であるLPAR1が高発現しており、LPAR1が血小板依存的な骨肉腫の浸潤能亢進や、マウス肺転移モデルにおいて肺転移結節が形成されるのに必須であることを明らかにしました。さらに、LPAR1の機能を阻害するLPAR1アンタゴニストを投与することで、骨肉腫の実験的肺転移が抑制されることをマウスモデルで示しました。
本研究は、Nature Publishing Groupのオープンアクセス誌『Oncogene』に、2021年7月23日に公開されました。
論文名、著者およびその所属
- 論文名
- Platelet-derived lysophosphatidic acid mediated LPAR1 activation as a therapeutic target for osteosarcoma metastasis
- ジャーナル名
- Oncogene(Nature Publishing Groupのオープンアクセス誌)
(※2021年7月23日にオンラインに掲載されました。) - 著者
- Satoshi Takagi1, Yuki Sasaki1, Sumie Koike1, Ai Takemoto1, Yosuke Seto1, Mizuki Haraguchi1, Takao Ukaji1, Tokuichi Kawaguchi2, Minoru Sugawara2, Masanori Saito3, Yuki Funauchi3, Keisuke Ae3, Seiichi Matsumoto4, Naoya Fujita5, Ryohei Katayama1**
(**責任著者) - 著者の所属機関
-
- (公財)がん研究会がん化学療法センター基礎研究部
- (公財)がん研究会がんプレシジョン医療研究センターがんゲノム医療開発プロジェクト
- (公財)がん研究会がん研有明病院整形外科
- (公財)がん研究会がん研有明病院サルコーマセンター
- (公財)がん研究会がん化学療法センター
- DOI
- 10.10381/s41388-021-01956-6
研究の詳細
背景と経緯
骨肉腫は、100万人に1~3人程度に発症する希少がんであり、患者の75%以上は25歳以下の小児や若年者です。主に四肢の骨に発生し、組織学的・遺伝学的に多様な性質を示す間葉系細胞を起源としています。その特徴として、高率に肺転移を来すことが知られており、転移・再発臓器の90%が肺であり、肺転移が予後不良因子です。
がんが他臓器に転移する際、がん細胞は血流中で血小板と相互作用することが知られています。がん細胞と血小板からなる凝集塊は、転移巣形成の足掛かりとなるだけでなく、血流シェアストレス(※4)や免疫細胞の攻撃からがん細胞を保護することが知られています。さらに、血小板から産生・放出される種々の増殖因子が、がん細胞の増殖を促進するだけでなく、上皮-間葉転換(※5)を誘導することでがん細胞の運動能亢進等を通じて転移を促進します。そのため、血小板はがんの遠隔転移に重要な役割を果たしていることが、様々な先行研究により明らかにされてきました。しかしながら、骨肉腫のような間葉系細胞を起源とする希少がんの転移機構については不明な点が多く残されているため、本研究ではその詳細なメカニズム解明を目的に、以下の検討を行いました。
研究内容
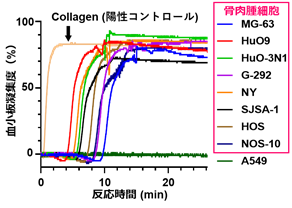
最初に、骨肉腫細胞が血小板を活性化する能力を持つかどうかを調べるために、調整した血小板懸濁液に骨肉腫細胞を添加し、血小板とがん細胞からなる凝集塊の形成度を血小板凝集計で計測しました。その結果、低転移性の肺がん細胞株A549では凝集塊の形成が全く誘導されなかったのに対して、骨肉腫細胞では8株全てにおいて、速やかに凝集塊が形成されました。このことから、骨肉腫細胞は血小板を活性化する能力が非常に高いことが明らかになりました(図2)。
血小板の主な生理的役割は創傷治癒であることから、その内部には細胞増殖や炎症を誘引する様々な生理活性物質が含まれており、血小板の活性化に伴い外部へと産生・放出されることが知られています。そこで、活性化血小板から産生・放出される生理活性物質(血小板放出物)が骨肉腫細胞に与える影響を評価したところ、血小板放出物は骨肉腫細胞の浸潤能を亢進することが明らかになりました。さらに、血小板放出物を熱処理した場合にも骨肉腫の浸潤能を亢進する活性が保持されたことから、耐熱性分子である脂質メディエータに着目して研究を進めたところ、この責任分子がリゾホスファチジン酸(LPA)であることを明らかにしました。
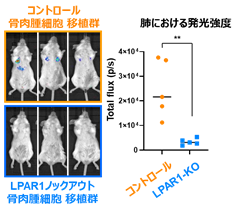
公共データベースに登録されている骨肉腫患者検体および細胞株のRNA-seqデータを再解析したところ、骨肉腫ではLPA受容体の一つであるLPAR1が高発現している可能性が示唆されたため、複数の骨肉腫細胞株と骨肉腫患者由来ゼノグラフト(※6)を用いて検証を行ったところ、骨肉腫では確かにLPAR1が高発現していることが確認されました。そこで、LPAR1をノックアウトした骨肉腫細胞を樹立しその浸潤能を評価したところ、LPAR1のノックアウトでは、血小板放出物により誘導される浸潤能の亢進が起こらなくなることがわかりました。また、LPAR1ノックアウト骨肉腫細胞にイメージングプローブAkaLuc(※7)を遺伝子導入し、その肺転移能を実験的肺転移モデルで評価したところ、骨肉腫細胞により形成される早期の肺転移結節がLPAR1のノックアウトにより阻害されることが観察されました(図3)。
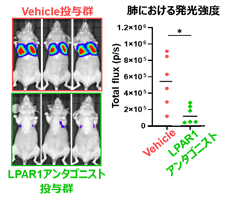
さらに、LPAR1の機能を阻害するLPAR1アンタゴニストをマウスに投与し、骨肉腫の実験的肺転移に与える影響を評価しました。その結果、LPAR1アンタゴニストの事前投与により、骨肉腫細胞の早期の肺への生着が有意に抑制されることが示されました(図4)。
本研究により、LPAR1の機能を阻害する薬剤は、骨肉腫の肺転移を抑制する分子標的薬となる可能性が示唆されました。なお、LPAR1アンタゴニストは、特発性肺線維症の治療薬として現在臨床試験下にありますが、骨肉腫患者に投与した際の安全性や有効性を明らかにするためには、臨床試験によるさらなる検討が必須になります。
本研究への支援
本研究は、以下の支援を受けて実施されました。
- 国立研究開発法人日本医療研究開発機構(AMED)次世代がん医療創生研究事業(P-CREATE)「脂質メディエータ受容体を標的とした骨肉腫の増殖・転移を阻害する新治療法の開発(研究代表者:高木聡)」、「腫瘍増殖・血行性転移を促進する血小板凝集促進分子ポドプラニン/Aggrusを標的にした新治療法の開発(研究代表者:藤田直也)」
- 日本学術振興会(JSPS)科学研究費補助金 挑戦的研究(萌芽)「がん免疫微小環境の新規制御因子である腫瘍内血小板の機能解析(研究代表者:高木聡)」
- 文部科学省(MEXT)科学研究費補助金 新学術領域研究(研究領域提案型)「細胞社会ダイバーシティーの統合的解明と制御(研究代表者:藤田直也)」
用語解説
- (※1)活性化血小板
- 生理的条件下において血小板は、休止型として血中を循環している。血管が損傷を受けることで血管内皮層下の基底膜が露出し、基底膜中のコラーゲンに血小板が接触すると、血小板内部に活性化シグナルが惹起され、活性化血小板となる。活性化に伴って、血小板ではFアクチンの形成亢進による劇的な形態変化が生じると共に、血小板に内包されたアルファ顆粒や濃染顆粒に蓄えられた様々な生理活性物質が血小板外部へと放出され、止血・凝固反応が開始される。
- (※2)リゾホスファチジン酸
- リゾリン脂質に分類される生理活性脂質(脂質メディエータ)の一つ。Gタンパク質共役受容体である6種類のLPA受容体(LPAR1~6)に結合することで、様々な細胞の分化、増殖、運動など多様な生理作用を発揮する。真核細胞では、様々な組み合わせでLPA受容体が発現しており、低分子量Gタンパク質に依存する複数のシグナル伝達経路を共有する。
- (※3)アンタゴニスト
- 生体内の受容体に結合することで、本来結合するべき物質と受容体の結合を阻害し、生体応答反応を起こさないよう作用する薬物。
- (※4)血流シェアストレス
- 血管内の血液の流れに起因する物理的力。血管内に侵入したがん細胞は、血流シェアストレスを受けることで傷害されることが知られている。
- (※5)上皮-間葉転換
- 上皮細胞が細胞極性や周辺細胞との接着能を失い、遊走能や浸潤能を得ることで間葉系様の細胞に変化する現象。正常組織の発生過程において重要な現象であるが、がん細胞に生じる上皮-間葉転換は、がん転移を促進することが示唆されている。
- (※6)ゼノグラフト
- 異なる種由来の組織を移植することを指し、がん研究では、ヒト由来のがん細胞や組織を免疫不全マウスに移植したゼノグラフトモデルが研究に用いられる。培養容器で増殖させる細胞株と比べて、より生体内の環境を再現した優れた実験系と考えられている。
- (※7)AkaLuc
- ホタルの発光酵素を遺伝子改変することで得られた人工酵素で、2018年に理化学研究所の宮脇博士、岩野博士らによって開発された(Iwano S et al, Science 359:935-939(2018))。人工基質AkaLumineと組み合わせた人工生物発光システムAkaBLIは、動物個体のバイオイメージングで一般的なホタルの生物発光システムと比べて、100~1,000倍の強さで生体深部のイメージングが可能となる。
お問い合わせ先
本研究に関すること
がん研究会 がん化学療法センター 基礎研究部
片山量平
〒135‐8550 東京都江東区有明3ー8ー31
TEL:03-3520-0111
がん研究会に関すること
がん研究会 広報課
TEL:03-3570-0775
がん対策全般についてのお問い合わせ
厚生労働省健康局 がん・疾病対策課
〒100-8916 東京都千代田区霞が関1-2-2
TEL:03-5253-1111(内線4605)
次世代がん医療創生研究事業に関するお問い合わせ
日本医療研究開発機構(AMED) 創薬事業部 医薬品研究開発課
〒100-0004 東京都千代田区大手町1-7-1
TEL:03-6870-2311
E-mail:cancer“AT”amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
関連リンク
掲載日 令和3年7月27日
最終更新日 令和3年7月27日


