昆虫がヒトと同様の腸ホルモンによる代謝調節の仕組みを持つことを発見
プレスリリース
国立大学法人筑波大学
国立研究開発法人日本医療研究開発機構
多くの生物で、代謝は食餌中の栄養に応じて綿密に制御されています。ヒトなどの脊椎動物では、インスリンとグルカゴンというホルモンが、糖からのエネルギー産生や脂肪への変換によるエネルギー蓄積を制御しており、その分泌調節には腸から分泌されるホルモンが作用しています。昆虫などの無脊椎動物にもインスリン様ホルモンとグルカゴン様ホルモンが存在し、エネルギー代謝に必須であることが知られていますが、その際の腸ホルモンの役割はよく分かっていませんでした。本研究は、キイロショウジョウバエにおいて、腸内分泌ホルモンのニューロペプチドF(腸NPF)が、食餌中の栄養素に応じてエネルギー産生を調節していることを初めて明らかにしました。
腸NPFは食餌中の糖に反応して血リンパ液へ分泌され、グルカゴン様ホルモンを産生する内分泌器官と、インスリン様ホルモンを産生する神経の双方を刺激することを見いだしました。また腸NPFは、インスリン様ホルモンの分泌は促進的に、グルカゴン様ホルモンの分泌は抑制的に調節することが判明しました。さらに、腸NPFを喪失させると、貯蔵脂肪の減少、過食、血糖値低下などの代謝異常が生じることから、昆虫の腸ホルモンも、ヒトなどと同様の働きをもつことが分かりました。
エネルギー代謝の制御は生活習慣病の発症に深く関連しており、本研究成果は、そのメカニズム追究における昆虫の有用性を示すものです。また、腸NPFは多くの昆虫に存在しており、農業害虫や衛生害虫のエネルギー代謝を撹乱する新たな技術開発にも資する可能性があります。
研究代表者
国立大学法人筑波大学 生存ダイナミクス研究センター
丹羽隆介 教授
研究の背景
生き物の多くは、食べ物の栄養分を消化吸収することにより、生存のためのエネルギーを得ています。栄養素の量や質に応じて適切にエネルギー産生を制御するためには、膵臓から分泌されるインスリン注1)やグルカゴン注2)といったホルモンの量を調節する必要があります。脊椎動物においては、栄養の情報を読み取り、膵臓へと情報を伝達するホルモンとして、インクレチン注3)と呼ばれる腸内分泌ホルモンが知られており、糖尿病や肥満といった生活習慣病治療のターゲットとしても注目されています(参考図下)。しかし、このインクレチンの報告はヒトなどの哺乳動物を含む脊椎動物の系に限られており、昆虫などの無脊椎動物にも同様の機能をもつホルモンが存在するのか否かは分かっていませんでした。
本研究グループは2018年に、雌キイロショウジョウバエにおいて、腸内で分泌されるホルモンであるニューロペプチドF(Neuropeptide F;NPF)注4)が生殖に重要な役割を持つことを見いだしています。NPFは脳と腸の両方で産生され、脳において産生されるNPF(脳NPF)は摂食を制御することが知られていますが、腸で産生されるNPF(腸NPF)の生殖以外の生命現象への役割は未解明でした。そこで本研究グループは、腸NPFが何らかの栄養依存的な現象に関わると予想し、キイロショウジョウバエを用いて、腸NPFがインクレチン様の機能を持つかどうかを調べました。
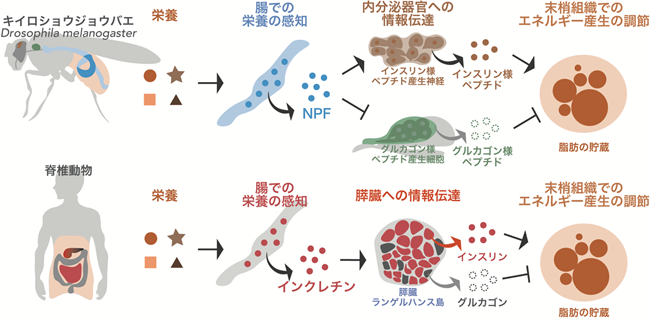
(下図)キイロショウジョウバエの腸NPFの役割は、脊椎動物においてインクレチンとして知られる腸ホルモンと同様であると考えられる。
研究内容と成果
まず、キイロショウジョウバエをさまざまな栄養条件の餌を用いて飼育し、腸NPFの分泌が、食餌中の糖によって調節されていることが明らかになりました。腸NPFの産生を阻害したところ、キイロショウジョウバエは貯蔵脂肪の減少、摂食量の増加、血糖値の減少といった代謝異常を示したことから、腸NPFは食餌中の糖を感知して、代謝を調節していることが分かりました。
次に、腸NPFは腸内分泌細胞から放出される神経伝達物質であることから、血リンパ液注5)へと分泌された後、NPF受容体(NPF receptor : NPFR)注6)を発現する組織によって受け取られると予想されました。そこで、キイロショウジョウバエにおいてNPFRを発現する組織を調べたところ、インスリン様の働きをするホルモンを産生する神経細胞、およびグルカゴン様の働きをするホルモンを産生する内分泌細胞でNPFRが発現していました。さらに、インスリン様ホルモン産生細胞おいてNPFRの機能を阻害したところ、インスリン様ホルモンの産生が抑えられました。一方、グルカゴン様ホルモン産生細胞におけるNPFRの阻害は、グルカゴン様ホルモンの分泌を促進しました。また、これらのホルモン産生細胞でNPFRの機能を阻害すると、腸NPFを阻害した際と同様に、貯蔵脂肪の減少といった代謝異常が生じました。これらのことから、腸NPFは、栄養の情報をインスリン様ホルモン産生神経、グルカゴン様ホルモン産生細胞といった内分泌器官へと伝達し、NPFRを介して食餌中の栄養素に応じた代謝調節を行っていることが明らかになりました(参考図上)。
これまで、昆虫を含む無脊椎動物に関して、脊椎動物における腸内分泌ホルモンのインクレチンに相当する機能を持つ分子の報告はありませんでした。本研究は、無脊椎動物においてインクレチン様腸ホルモンの存在を示す初めての成果です。
今後の展開
本研究により、無脊椎動物において、腸NPFが、食餌に応じた代謝調節に重要であることが分かりました。食餌中の糖に反応した腸ホルモンを介したエネルギー代謝の制御は、人の生活習慣病の発症に深く関連することが知られていますが、その全容はいまだ解明されていません。本研究成果は、こうした未解明のメカニズムの追究における昆虫の有用性を示すものです。今後は、腸NPFと栄養、生殖の三者の関係を明らかにするとともに、腸NPFの持つ他の役割や、腸NPFの分泌がどのように制御されているのか、さらに若年期に摂取した栄養の履歴に伴う後期ライフステージでのエネルギー代謝の変化に腸NPFがどのような影響をもたらすかを明らかにしていきます。これにより、ヒトをはじめとする脊椎動物や昆虫に共通する腸ホルモンによる代謝調節系の包括的理解につながると考えられます。さらに、NPFの存在は他の昆虫にも広く見られることから、農業害虫や衛生害虫のエネルギー代謝を撹乱する新たな技術開発の標的になる可能性があります。例えば、蚊をはじめとする吸血性昆虫の吸血・摂食行動の制御にも腸NPFが関わるのであれば、NPFとNPFRが昆虫の吸血行動によって媒介される病原体の蔓延を防ぐためのターゲットになり得ます。
用語解説
- 注1)インスリン
- 膵臓のランゲルハンス島と呼ばれる組織の中に存在するβ細胞(膵β細胞)から分泌されるホルモン。各組織へと働きかけ、血中の糖の取り込みや脂肪の貯蔵を促進する役割を持つ。
- 注2)グルカゴン
- 膵臓ランゲルハンス島α細胞(膵α細胞)から分泌されるホルモン。インスリンと拮抗した役割を持ち、各組織へと働きかけることで脂肪の分解や血糖値の上昇を促す。
- 注3)インクレチン
- 栄養に応答して腸内分泌細胞から放出され、膵臓ランゲルハンス島β細胞へと働きかけることでインスリンの分泌を促すホルモンの総称。脊椎動物においては、Glucagon-like peptide-1(GLP-1)やGastric inhibitory polypeptide (GIP) が知られている。
- 注4)ニューロペプチドF(Neuropeptide F; NPF)
- 無脊椎動物の神経伝達物質として同定されたペプチドホルモン。キイロショウジョウバエにおいては脳や腸で産生され、摂食行動や交尾行動、攻撃的行動などに関わる。脊椎動物のNeuropeptide Yの類縁分子。
- 注5)血リンパ液
- 昆虫をはじめとする節足動物の体内を循環している体液。
- 注6)ニューロペプチドF受容体(NPFR)
- NPFを受容するグアニンヌクレオチド結合タンパク質共役型受容体。
研究資金
本研究は、国立研究開発法人日本医療研究開発機構(AMED)革新的先端研究開発支援事業(AMED-CREST)「全ライフコースを対象とした個体の機能低下機構の解明」研究開発領域における研究開発課題「成長期の栄養履歴が後期ライフステージに与える機能低下のメカニズム」(研究期間:平成29年度~令和4年度、研究開発代表者:上村匡、研究開発分担者:丹羽隆介)、日本学術振興会科学研究費助成事業 基盤研究(A)(研究期間:平成26~28年度、平成29年度~令和元年度)、基盤研究(B)(研究期間:令和元年度~令和3年度)、および特別研究員奨励費(研究期間:平成30年度~令和2年度)の支援により実施されました。
掲載論文
- 題名
- The sugar-responsive enteroendocrine neuropeptide F regulates lipid metabolism through glucagon-like and insulin-like hormones in Drosophila melanogaster
(キイロショウジョウバエにおいて、糖応答性の腸内分泌ホルモンNeuropeptide Fはグルカゴン様およびインスリン様ホルモンを介して脂肪代謝を制御する) - 著者名
- Yuto Yoshinari(吉成祐人 筑波大学生存ダイナミクス研究センター 研究員)、Hina Kosakamoto(小坂元陽奈 東京大学大学院薬学系研究科博士後期課程3年生・日本学術振興会特別研究員DC2)、Takumi Kamiyama(上山拓巳 筑波大学大学院生命環境科学研究科・博士後期課程3年生・日本学術振興会特別研究員DC2)、Ryo Hoshino(星野涼 筑波大学大学院理工情報生命学術院生命地球科学研究群・日本学術振興会特別研究員DC1)、Rena Matsuoka(松岡怜奈 筑波大学大学院生命環境科学研究科(当時))、Shu Kondo(近藤周 国立遺伝学研究所 助教(当時))、Hiromu Tanimoto(谷本拓 東北大学大学院生命科学研究科 教授)、Akira Nakamura(中村輝 熊本大学薬学部 教授)Fumiaki Obata(小幡史明 理化学研究所生命機能科学研究センター チームリーダー)、Ryusuke Niwa(丹羽隆介 筑波大学生存ダイナミクス研究センター 教授)
- 掲載誌
- Nature Communications
- 掲載日
- 2021年8月10日
- DOI
- 10.1038/s41467-021-25146-w
お問合わせ先
研究に関すること
丹羽隆介(にわ りゅうすけ)
国立大学法人筑波大学 生存ダイナミクス研究センター 教授
TEL:029-853-7342
E-mail:ryusuke-niwa“AT”umin.ac.jp
Niwa Lab Tsukuba
取材・報道に関すること
国立大学法人筑波大学広報室
TEL:029-853-2040
E-mail:kohositu“AT”un.tsukuba.ac.jp
AMED事業に関すること
国立研究開発法人日本医療研究開発機構(AMED)
シーズ開発・研究基盤事業部 革新的先端研究開発課
TEL:03-6870-2224
E-mail:kenkyuk-ask“AT”amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
関連リンク
掲載日 令和3年8月18日
最終更新日 令和3年8月18日


