プレスリリース 第三世代アルツハイマー病モデルマウスの作製―アミロイドを標的とした新しい治療法の開発に向けて―
プレスリリース
理化学研究所
日本医療研究開発機構
理化学研究所(理研)脳神経科学研究センター神経老化制御研究チームの佐藤香織大学院生リサーチ・アソシエイト、笹栗弘貴副チームリーダー、西道隆臣チームリーダーらの共同研究グループ※は、ヒトと同じアミノ酸配列を持つアミロイドβ(Aβ)ペプチド[1]が早期から脳内に蓄積し、アルツハイマー病(AD)[2]患者により近い病理を早期から呈するADモデルマウスの作製に成功しました。
本研究成果は、AD患者の脳でAβペプチドが蓄積するアミロイド病理の機序がより詳しく解明されることで、Aβペプチドを標的とした新しい治療法の開発に貢献するものと期待できます。
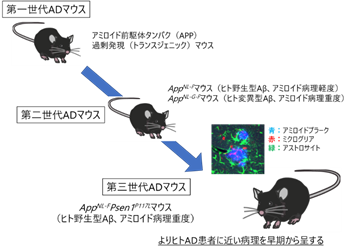
これまでAD研究では、脳内にアミロイド前駆体タンパク(APP)[3]を過剰に発現させた第一世代ADモデルマウスに続き、家族性AD[2]のAPP遺伝子変異を複数、マウスの遺伝子に導入した第二世代ADモデルマウスが広く利用されてきました。しかし、第二世代モデルマウスではアミロイド病理の再現に時間がかかる、あるいはAβペプチドの配列がヒトと異なるなどの問題がありました。
今回、共同研究グループは、過去に作製した二つのADモデルマウスを交配することで、新しい第三世代ADモデルマウスを作製しました。このモデルマウスでは、変異のないヒトと同じアミノ酸配列のAβペプチドが脳内に、早期から大量に産生され、蓄積することから、AD患者と同様の顕著な脳内アミロイド病理を短期間で再現できます。
本研究は、科学雑誌『Journal of Biological Chemistry』オンライン版(2021年8月25日付)に掲載されました。
※共同研究グループ
- 理化学研究所 脳神経科学研究センター 神経老化制御研究チーム
- 大学院生リサーチ・アソシエイト 佐藤 香織(さとう かおり)
- 研究員 綿村 直人(わたむら なおと)
- テクニカルスタッフⅠ 藤岡 亮(ふじおか りょう)
- テクニカルスタッフⅠ 三平 尚美(みひら なおみ)
- テクニカルスタッフⅠ 関口 みさき(せきぐち みさき)
- 副チームリーダー 笹栗 弘貴(ささぐり ひろき)
- チームリーダー 西道 隆臣(さいどう たかおみ)
- 名古屋大学大学院 医学系研究科 機能組織学
- 特任助教 永田 健一(ながた けんいち)
- 早稲田大学 先進理工学部 生命医科学科
- 教授 大島 登志男(おおしま としお)
- 名古屋市立大学大学院 医学系研究科
- 教授 斉藤 貴志(さいとう たかし)
研究支援
本研究は、日本医療研究開発機構(AMED)「革新的技術による脳機能ネットワークの全容解明プロジェクト(プロジェクトリーダー:岡野栄之、宮脇敦史)」、日本学術振興会(JSPS)科学研究費助成事業基盤研究(C)「ゲノム編集技術を利用した変異プレセニリンによるアルツハイマー病機序の系統的解析(研究代表者:笹栗弘貴)」による支援を受けて行われました。
背景
超高齢化社会を迎えた日本では、アルツハイマー病(AD)の患者数は増加の一途をたどっています。医療経済のみならず、介護などの社会的負担も増加していることから、ADの病態解明と治療方法の確立が喫緊の課題となっています。
ADのような複雑な神経疾患の研究には、動物モデルが必要不可欠です。これまで長年にわたり、ADに関連するタンパク質を過剰に脳内に発現させたトランスジェニックマウス[4](第一世代ADマウスモデル)が使用されてきました。しかし、特定の分子が非生理的に過剰に産生される状況では、さまざまな不自然な作用が生じ、実際のADとは関係のない現象を間違って解釈することがしばしば起こりました。
この問題を回避するために、神経老化制御研究チームでは第二世代ADマウスモデルを2014年に作製しました注1)。ADで見られる主要な脳病理の一つが「老人斑」と呼ばれる凝集体の形成(アミロイド病理)で、その主成分はアミロイドベータ(Aβ)と呼ばれる40個程のアミノ酸がつながったペプチドです。第二世代ADマウスモデルでは、家族性ADに関連する遺伝子変異を複数、マウスの遺伝子に導入することで、過剰発現に頼ることなく、このアミロイド病理を脳内に再現することに成功しました。現在では、標準的なADモデルマウスとして全世界で受け入れられ、これまでに500以上もの研究室や企業に提供してきました。
一方で、第二世代ADマウスモデルにも欠点がありました。主に2種類のモデルがあり、一つはAppNL-Fマウス、もう一つはAppNL-G-Fマウスと呼ばれます。これらは、それぞれ家族性ADに関連するアミロイド前駆体タンパク遺伝子(APP遺伝子)の変異を、マウスApp遺伝子に二つないし三つ持っており、脳内にアミロイド病理の形成、ミクログリア[5]などによる神経炎症を再現し、認知機能障害を呈します(図1)。
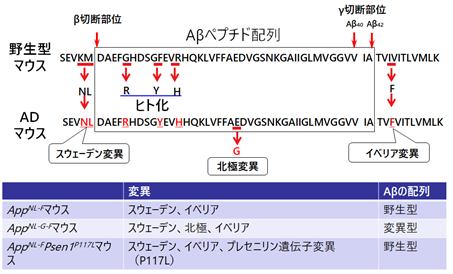
しかし、ヒト野生型Aβペプチドを持つAppNL-Fマウスでは、アミロイド病理が出現するのに時間がかかり、顕著な病理を呈するまで18カ月程度を要します。一方、ヒト変異型Aβペプチドを持つAppNL-G-Fマウスでは、反対に凝集体が形成されやすく、2~3カ月でアミロイド病理が出現し、6カ月齢で顕著なアミロイド病理が見られます。しかし、Aβペプチド配列内の変異のために、Aβペプチドやアミロイド凝集体に対するタンパク分解酵素をはじめとする分子の反応性や、抗体療法で使用される抗体の結合性も異なるため、正確に評価できないという懸念がありました。
そこで、今回共同研究グループは、これらの問題を解決するために、第三世代ADモデルマウスの作製を試みました。
注1)2014年4月14日理化学研究所プレスリリース「次世代アルツハイマー病モデルマウスの開発に成功」
研究手法と成果
共同研究グループは、第三世代のADモデルマウスとして、第二世代ADモデルマウスであるAppNL-Fマウスと、家族性ADの別の原因遺伝子であるプレセニリン1(PSEN1)遺伝子[6]に変異を持つプレセニリンマウス(Psen1P117Lマウス)を交配し、二重変異マウス(AppNL-FPsen1P117Lマウス)を作製しました。
AD患者では、健常者で主に見られるAβ40ペプチド(アミノ酸が40個結合)と比較して、凝集しやすいAβ42ペプチドやAβ43ペプチド(42個または43個アミノ酸が結合)という長いペプチドが増加していることが知られています。マウス脳内のAβペプチドを定量した結果、AppNL-FPsen1P117Lマウスでは、AppNL-Fマウスと比較してAβ42ペプチドの量が25倍前後に増加し、Aβ43ペプチドの量も増えていることが判明しました。これは、APP遺伝子変異とPSEN1遺伝子変異のAD病態への影響は相加的あるいは相乗的であることを示しています。
AppNL-Fマウス、AppNL-FPsen1P117Lマウス、AppNL-G-Fマウスの脳内アミロイド病理を免疫組織化学染色により解析した結果、AppNL-FPsen1P117Lマウスでは、AppNL-Fマウスと比較してアミロイド病理が著しく増加しており、3カ月齢から脳内に出現し、12カ月齢では顕著になり、AppNL-G-Fで見られるアミロイド病理と同程度となっていることが判明しました。さらに詳しく病理学的特徴を解析したところ、AppNL-FPsen1P117Lマウスではアミロイド病理が主に大脳皮質や海馬[7]に見られ、中心核を持つアミロイド凝集体(cored plaque)[1]が多数見られました(図2)。このアミロイド病理の脳内での分布および凝集体の形状はヒトAD患者のものとよく類似しています。また、ADのもう一つの病理学的特徴であるミクログリアやアストロサイト[5]などのグリア細胞[5]による神経炎症も再現されていました。
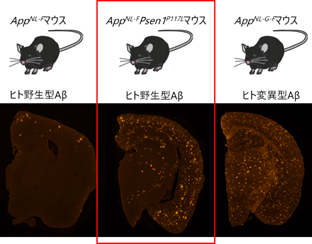
下段:12カ月齢のマウス脳の画像。第三世代モデルマウスであるAppNL-FPsen1P117Lマウス(中央)では、AppNL-Fマウス(左)と比較して、より早期から重度のアミロイド病理(赤)がマウス脳に出現しており、その重症度はAppNL-G-Fマウス(右)と同程度であった。
今後の期待
第三世代ADモデルマウスでは、Aβペプチド配列の中に変異がないため、多くの遺伝性でない(孤発性)AD患者と同じ配列のAβが脳内に蓄積します。このモデルでAβの代謝や排泄を調べることにより、広くAD患者に適用できる治療法を検証することが可能です。また、最近米国食品医薬品局(FDA)に承認されたアデュカヌマブやその他の抗体の前臨床研究にも有用であり、ヒトを対象とした治験と違い、認知能力に対する検証も容易です。
これまで、第二世代ADマウスモデルは、国内外の多くの研究室、企業に提供されてきましたが、今後は第三世代ADマウスモデルも重要なモデルとして広く利用されると考えられます。ADの研究界にこれらのマウスモデルを提供することで、さらなるADの病態解明や治療法開発が促進されるものと期待できます。
論文情報
- タイトル
- A 3rd generation mouse model of Alzheimer's disease shows early and increased cored plaque pathology composed of wild-type human amyloid β peptide
- 著者名
- Kaori Sato, Naoto Watamura, Ryo Fujioka, Naomi Mihira, Misaki Sekiguchi, Kenichi Nagata, Toshio Ohshima, Takashi Saito, Takaomi C. Saido and Hiroki Sasaguri
- 雑誌
- Journal of Biological Chemistry
補足説明
- [1]アミロイドβ(Aβ)ペプチド、中心核を持つアミロイド凝集体(cored plaque)
- アミロイド前駆体タンパク(APP)から、タンパク分解酵素によって切断されて精製される40アミノ酸ほどの長さのペプチド。アルツハイマー病患者の脳に出現する老人斑と呼ばれる凝集体の主要な構成成分であり、アルツハイマー病発症に関与する重要な分子と考えられている。複数の形状の老人斑があることが知られており、中心核を持つアミロイド凝集体(cored plaque)は、アルツハイマー病との関連が高いとされている。一方、中心核のないびまん性アミロイド凝集体(diffuse plaque)は、認知機能が正常な高齢者でもしばしば認められる。
- [2]アルツハイマー病(AD)、家族性AD
- アルツハイマー病はドイツの精神科医、アルツハイマー博士により1905年に報告された進行性の記憶障害を伴う認知症。主に中高年で発症し、徐々に進行して生活に支障を来すようになり、最終的には意思疎通ができなくなる。日本を含む先進国では、高齢期発症の認知症のうち最も多いタイプの疾患となっている。家族歴を伴うものを家族性AD、伴わないものを孤発性ADと呼ぶ。
- [3]アミロイド前駆体タンパク(APP)
- Aβペプチドのもととなる部分が含まれているタンパク質。アミロイド前駆体タンパクが複数のタンパク分解酵素によって切断される結果、老人斑のもととなるAβペプチドが産生される。家族性アルツハイマー病の患者の一部は、アミロイド前駆体タンパクをコードする遺伝子に変異を持つ。APPはamyloid precursor proteinの略。
- [4]トランスジェニックマウス
- 一般には、遺伝子の機能や疾患への影響を研究する目的でゲノムが改変されたマウスの総称であるが、特定の遺伝子を過剰発現したマウスのことを指すことが多い。目的の遺伝子を含むDNA断片をマウス胚に導入すると、その断片がマウスのゲノムDNAに挿入され、生体内でその遺伝子が発現した遺伝子改変マウスができる。
- [5]ミクログリア、アストロサイト、グリア細胞
- グリア細胞は、脳にある非神経細胞で、神経細胞の生存や発達、機能発現のための脳内環境維持、代謝のサポートを行っている。オリゴデンドロサイト、ミクログリア、アストロサイトの3種類が存在し、ミクログリアは脳の免疫機能を担い、アストロサイトは神経伝達物質の取り込みや神経栄養因子の供給などを行う。
- [6]プレセニリン1(PSEN1)遺伝子
- プレセニリン1というタンパク質をコードする遺伝子。家族性アルツハイマー病の患者の中では、この遺伝子に変異を持つ患者が最も多い。プレセニリン1タンパク質は、アミロイド前駆体タンパク質からAβペプチドを切り出す作用があり、アルツハイマー病の発症過程で重要な因子の一つである。
- [7]海馬
- ヒトでは大脳の側頭葉内側部に存在する、記憶や学習に重要な役割を果たす脳領域。アルツハイマー病で、神経細胞の脱落、萎縮が強く認められる部位であり、主要な症状である記憶障害の責任病巣と考えられている。
発表者・機関窓口
発表者
理化学研究所 脳神経科学研究センター 神経老化制御研究チーム
大学院生リサーチ・アソシエイト 佐藤 香織(さとう かおり)
副チームリーダー 笹栗 弘貴(ささぐり ひろき)
チームリーダー 西道 隆臣(さいどう たかおみ)
機関窓口
理化学研究所 広報室 報道担当
E-mail:ex-press[at]riken.jp
*今般の新型コロナウイルス感染症対策として、理化学研究所では在宅勤務を実施しておりますので、メールにてお問い合わせ願います。
AMED事業について
日本医療研究開発機構 疾患基礎研究事業部 疾患基礎研究課
TEL:03-6870-2286 FAX:03-6870-2243
革新脳担当 E-mail:brain-m[at]amed.go.jp
※E-mailは上記アドレス[at]の部分を@に変えてください。
掲載日 令和3年8月27日
最終更新日 令和3年8月27日


