B型肝炎ウイルスによる肝発癌機構を新たに同定
プレスリリース
東京大学
日本医療研究開発機構
発表者
關場 一磨(東京大学医学部附属病院 消化器内科 特任臨床医 ※研究当時;現在 スタンフォード大学留学中)
大塚 基之(東京大学医学部附属病院 消化器内科/東京大学大学院医学系研究科 内科学専攻 消化器内科学 講師)
小池 和彦(東京大学医学部附属病院 消化器内科/東京大学大学院医学系研究科 内科学専攻 消化器内科学 教授 ※研究当時;現在 関東中央病院 院長)
発表のポイント
- 今まで明らかとなっていなかったB型肝炎ウイルス(HBV,注1)による肝発癌機構の一端を解明するとともに、HBV関連肝発癌を抑止する新たな方法を見出しました。
- HBVが感染した肝細胞では、HBVが産生するウイルス蛋白HBx(注2)により宿主蛋白Smc5/6(注3)が分解されることで、Smc5/6蛋白の本来有する宿主DNAダメージ修復機能が低下し、肝発癌促進の原因になることを明らかにしました。
- 現在のHBV治療の第一選択薬である核酸アナログ製剤(注4)はウイルスDNAの産生を効率的に阻害しますが、肝癌の発生を完全に抑えることはできません。本研究成果をきっかけにHBV関連肝発癌を抑止する新たな方法として、Smc5/6蛋白の分解抑制という手法が発展していくことが期待されます。
発表概要
HBVは、全世界で2億5千万人以上が持続感染し、HBV関連疾患により毎年約82万人が死亡しており、その克服は日本のみならず世界的な重要課題です。特に、死亡原因の多くを占めるのが肝癌ですが、既存のHBV治療薬では発癌をゼロにすることはできず、また、そもそもの発癌機構も十分には解明されていませんでした。
そうした中、ウイルス蛋白HBxは宿主蛋白Smc5/6を分解することでウイルス複製を促進するという報告がなされました。本来、宿主蛋白Smc5/6は宿主DNAダメージ修復機構に重要な蛋白質であることから、東京大学医学部附属病院 消化器内科の關場一磨特任臨床医(研究当時)、大塚基之講師、小池和彦教授(研究当時)らの研究グループは、「HBVが産生するウイルス蛋白HBxは宿主蛋白Smc5/6を分解することで、ウイルス複製を促進するだけでなく、宿主DNAダメージの修復阻害にも働いているのではないか」と考え検証を行いました。
実際に、ヒト検体やマウスモデル、HBx過剰発現細胞などを用いた検討で、宿主蛋白Smc5/6がウイルス蛋白HBxにより分解されると、宿主DNAダメージ修復能も低下することが分かりました。一般的にDNAダメージの蓄積は主要な発癌促進因子であり、研究グループの検証でも宿主蛋白Smc5/6が分解されている細胞で腫瘍形成能の亢進を認めました。さらに、ウイルス蛋白HBxの働きを抑制する化合物ニタゾキサニド(注5)をHBV感染細胞に投与すると、宿主蛋白Smc5/6の分解が阻害され、宿主DNAダメージ修復能が回復することが分かりました。
以上より、本研究は今まで明らかとなっていなかったHBV関連肝発癌の機序の一端を解明するとともに、「Smc5/6分解阻害薬による発癌抑止」という発癌予防の新たなコンセプトを提唱するものとなりました。本研究成果は、中央ヨーロッパ夏時間2021年9月1日にJournal of Hepatology(オンライン版)にて発表されました。
なお、本研究は日本医療研究開発機構(AMED)肝炎等克服実用化研究事業の肝炎等克服緊急対策研究事業(研究開発課題名「近接依存性標識法を用いたHBV cccDNA維持に関わる宿主因子の網羅的同定と制御」研究代表者:關場一磨、「B型肝炎ウイルスRNAと相互作用する宿主因子の網羅的同定とその制御による病態制御法開発」・「慢性炎症を背景とした肝発癌の機序解明と肝癌高危険群の囲い込み法の開発」研究代表者:大塚基之)とB型肝炎創薬実用化等研究事業(研究開発課題名「新規メカニズムに基づくB型肝炎治療薬の探索」研究代表者:森屋恭爾)、および文部科学省科学研究費補助金などの支援により行われました。
発表内容
研究の背景
HBVは肝発癌を引き起こすウイルスで、既存の治療ではその発症をゼロにすることはできません。肝発癌の重要な因子として、HBVが産生するウイルス蛋白HBxが知られていましたが、HBx蛋白による詳細な発癌機序は十分に解明されておらず、新たな治療薬開発の大きな障害となっていました。研究グループは、「ウイルス蛋白HBxが宿主蛋白Smc5/6を分解してウイルス転写を活性化している」という報告(Decorsière et al. Nature 2016; Murphy et al. Cell Rep. 2016)と「宿主蛋白Smc5/6はDNAダメージ修復に関わる」という報告(De Piccoli et al. Nat Cell Biol. 2006)に着目して、「ウイルス蛋白HBxによる宿主蛋白Smc5/6の分解は、ウイルス複製の亢進だけでなく宿主DNAダメージの修復阻害という二つの働きを持つ」のではないかと仮説を立てました。
研究内容
まず、研究グループはHBV陽性ヒト肝組織やHBV感染ヒト肝細胞キメラマウス(注6)、HBxトランスジェニックマウス(注7)を用いて、Smc5/6の発現量とDNAダメージ蓄積量との相関を検討したところ、HBV感染やHBx発現に伴いSmc5/6の発現が低下している組織で、DNAダメージの蓄積が有意に増加していることを確認しました。
そこで、細胞株を用いた検討で、Smc5のノックダウン(注8)を行い、DNAダメージを誘導すると通常の細胞と比較して、宿主DNAダメージ修復が阻害されていることが分かりました(図1)。HBx強制発現細胞でも同様の結果が得られたうえに、Smc5/6の分解能を持たない変異型HBxではこの宿主DNAダメージ修復阻害効果がないことを確認しました。
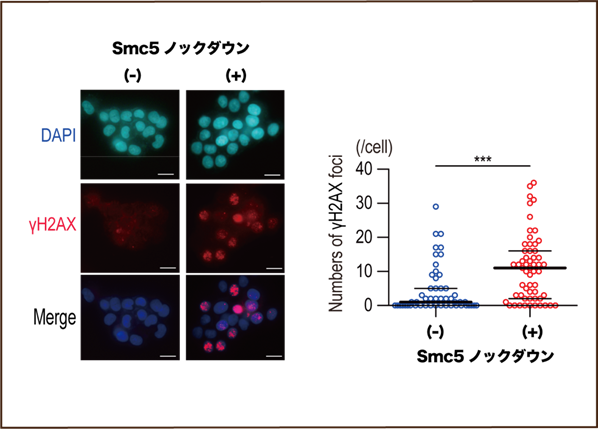
さらに、NTCP強制発現細胞(注9)や初代ヒト肝細胞(注10)を用いたHBV感染実験で、Smc5/6が分解されるとDNAダメージ誘導時の修復が阻害されていることが分かりました。ここで、研究グループが以前に同定した、HBV感染下でSmc5/6分解阻害作用を有する化合物ニタゾキサニド(Sekiba et al. Cell Mol Gastroenterol Hepatol. 2019)を細胞に投与してSmc5/6の分解を阻害すると、宿主DNAダメージ修復能も回復することが実証されました。また、Smc5/6の分解を受けた細胞では腫瘍形成能が上昇していることを細胞株およびマウスを用いた実験系で確認しました。
以上のことから、HBVはウイルス蛋白HBxを産生し宿主蛋白Smc5/6を分解することでウイルスの転写を活性化しているだけでなく、宿主DNAダメージ修復も阻害していることが示唆されました(図2)。
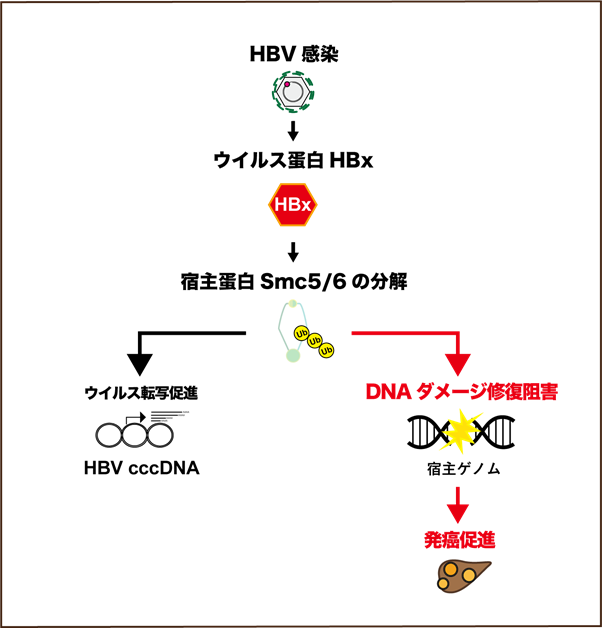
社会的意義・今後の予定
これらの結果は、ウイルス蛋白HBxによる肝発癌機構を明らかにするとともに、宿主蛋白Smc5/6の分解阻害という肝癌抑制のための新たな治療標的を提唱するものであります。ニタゾキサニドに関しては、抗HBV薬の候補として国際的な治験(NCT03905655)が行われており、そのウイルス複製阻害効果を注視するとともに、発癌抑制効果についても検証を重ねて、臨床応用の可能性を探っていきたいと本研究グループは考えています。
発表雑誌
- 雑誌名
- Journal of Hepatology
- 論文タイトル
- Degradation of Smc5/6 Complex Impairs Homologous Recombination-Mediated Repair of Damaged DNA
- 著者
- 關場一磨、大塚基之*、船戸和義、宮川 祐、田中恵理、清宮崇博、山上まり、堤 武也、奥新和也、宮川 敬、梁 明秀、小池和彦(*責任著者)
- DOI番号
- 10.1016/j.jhep.2021.08.010
- アブストラクトURL
- https://www.sciencedirect.com/science/article/pii/S0168827821020055
用語解説
- (注1)B型肝炎ウイルス
- 血液や体液などを介して肝臓に感染するDNAウイルス。感染したウイルスは炎症(肝炎)を惹起し、肝硬変や肝癌の原因となる。世界保健機関(WHO)は、B型肝炎ウイルス感染者は世界中で20億人、そのうちB型肝炎ウイルス持続感染者は2.96億人、さらに年間82万人がB型肝炎ウイルス関連疾患で死亡していると報告し、その克服を重要課題として挙げている。
- (注2)ウイルス蛋白HBx
- HBVが産生する蛋白質の一つ。ウイルス蛋白の中で、ウイルス複製の制御や発癌促進といった重要な役割を担うとされるが、その詳細は未だ不明な点も多い。
- (注3)Smc5/6
- Structural maintenance of chromosomes 5/6の略。B型肝炎ウイルスのcccDNA(covalently closed circular DNA;B型肝炎ウイルスが肝細胞内に侵入後に、もともと不完全環状二本鎖の形態をとっているウイルスDNAが核内に移行して形成される完全閉鎖環状二本鎖DNA。核内に安定的に存在し続け、ウイルスRNAを作るための鋳型として働く)に結合し、ウイルスRNA転写の強力な阻害因子となるはずが、ウイルス蛋白HBxによって分解されてしまうことが近年明らかとなった。Smc5とSmc6はヘテロダイマーを形成して機能し、一方が分解されるともう一方も不安定化し分解される。
- (注4)核酸アナログ製剤
- B型肝炎の治療に広く用いられているウイルスDNA複製阻害剤。B型肝炎ウイルスはその生活環の中で、プレゲノムRNAからDNAへの逆転写を行うが、核酸アナログ製剤はウイルスDNAポリメラーゼ/逆転写酵素による基質の取り込みを競合的に阻害してDNA鎖の伸長を停止することでウイルスの増殖を阻害する。エンテカビルやテノホビルがその代表薬。その作用原理上、ウイルスRNAおよびウイルス蛋白質の産生を阻害することはできない。
- (注5)ニタゾキサニド
- チアゾリド系化合物で、米国では抗寄生虫薬としてアメリカ食品医薬品局で承認されている。その他の細菌やウイルスにも広範囲なスペクトルを持つことが報告されているが、本研究グループではウイルス蛋白HBxと宿主蛋白DDB1との結合を阻害することで宿主蛋白Smc5/6の分解を阻害し抗HBV効果を発揮すると以前に報告(Sekiba et al. Cell Mol Gastroenterol Hepatol. 2019)した。
- (注6)ヒト肝細胞キメラマウス
- 肝臓の70%以上を正常なヒト肝細胞に置換した特殊なマウス。HBVはヒトやチンパンジーなど、感染できる宿主が限られており通常のマウスでは感染実験を行うことができないため、ヒト肝細胞キメラマウスを用いる必要がある。
- (注7)HBxトランスジェニックマウス
- 遺伝子組換え技術を用いて、ウイルス蛋白HBxが肝細胞で発現するように遺伝子操作したマウス。
- (注8)ノックダウン
- 特定の遺伝子の転写量を抑制する技術。
- (注9)NTCP強制発現細胞
- HBVが肝細胞に侵入する際には細胞表面のNTCPという胆汁酸トランスポーターを利用する。実験に用いる通常のヒト肝細胞ではNTCPの発現が低下しており、HBVの感染能を持たないため、遺伝子組換え技術によりNTCPの発現量を強制的に増加した細胞がHBV感染実験には必要。
- (注10)初代ヒト肝細胞
- ヒトから採取された肝臓組織から培養した細胞。NTCP強制発現細胞よりも高いHBV感染能を有する。
お問い合わせ先
研究内容に関するお問い合わせ先
東京大学医学部附属病院 消化器内科
特任臨床医(研究当時)關場 一磨(せきば かずま)
E-mail:ksekiba-tky“AT”umin.ac.jp
講師 大塚 基之(おおつか もとゆき)
電話:03-5800-8812(研究室直通)
E-mail:otsukamo-tky“AT”umin.ac.jp
取材に関するお問い合わせ先
東京大学医学部附属病院 パブリック・リレーションセンター
担当:渡部、小岩井
電話:03-5800-9188(直通)
E-mail:pr“AT”adm.h.u-tokyo.ac.jp
AMEDの事業に関するお問い合わせ
日本医療研究開発機構 疾患基礎研究事業部 疾患基礎研究課
(肝炎等克服実用化研究事業 担当)
電話:03-6870-2225 FAX:03-6870-2243
E-mail:hepatitis“AT”amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
関連リンク
掲載日 令和3年9月1日
最終更新日 令和3年9月1日


