プレスリリース 胃酸を分泌するタンパク質を改造!?―輸送するイオンの数を人工的に変えることに成功―
プレスリリース
東海国立大学機構名古屋大学
日本医療研究開発機構
国立大学法人東海国立大学機構名古屋大学細胞生理学研究センターの阿部一啓准教授らの研究グループは、胃酸の分泌を担う膜タンパク質である「胃プロトンポンプ」を人工的に改変することで、輸送するイオンの個数を変化させることに成功しました。この成果によって、膜タンパク質が行うイオン認識機構の一端が明らかになりました。
食物を消化するときに、胃の中は塩酸(HCl)で満たされ強い酸性になります(pH1)。「胃プロトンポンプ」は、胃の表面にある膜タンパク質で、胃酸(H+)を細胞内から胃の中へ輸送し、同時にカリウムイオン(K+)を細胞内に輸送します。「胃プロトンポンプ」と良く似たタンパク質である「ナトリウムポンプ」はK+を2つ輸送しますが、「胃プロトンポンプ」は1つだけしか輸送することができず、この理由は40年以上もの長い間、不明でした。
本研究では、「胃プロトンポンプ」にK+が2つ結合するようにデザインした変異体を人工的に創り出すことに世界で初めて成功し、K+が2つ結合した状態をクライオ電子顕微鏡により「視る」ことで証明しました。
本研究成果は、2021年9月29日付(日本時間2021年9月29日19時)Nature Communications誌に掲載されました。
本研究は、科学研究費補助金・基盤研究(21H02426)、AMED創薬等ライフサイエンス研究支援基盤事業(BINDS)JP21am0101074の支援のもとで行われたものです。
ポイント
- 胃酸分泌を担う膜タンパク質・胃プロトンポンプのメカニズムの研究
- 1つしか結合しないカリウムイオン(K+)を2つ結合できるようにタンパク質をデザイン
- クライオ電子顕微鏡によって、2つ結合したカリウムイオンを視ることに成功
研究背景と内容
我々が食物を摂取すると、胃酸(塩酸)が分泌され、胃の内部はpH(ペーハー)1という、非常に酸性度の高い状態になります。この強酸性環境(塩酸に換算して0.1 mol/l)は、タンパク質分解酵素ペプシンの活性化に必要で、タンパク質の消化にとってなくてはならないものです(図1左)。また、この強酸性環境はバクテリアの繁殖を抑える効果もあります(図1中)。このように、「消化」という我々の生命の営みにとって欠くことが出来ない重要な働きを担う胃酸ですが、時としてこの強酸性環境は自身に牙を剥きます。暴飲暴食、様々なストレスなどにより、胃酸と胃粘膜分泌のバランスが崩れると、胃酸は胃本体を傷つけ、不快な胸焼けや、ひどい場合には胃潰瘍といった重篤な症状を呈します。このような症状の治療には、胃酸抑制剤が用いられます(図1右)。
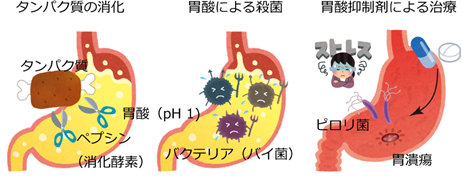
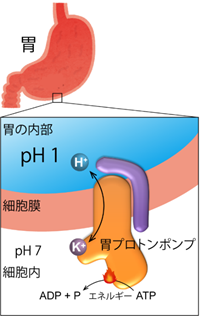
胃内部の強酸性環境を生み出すために中心的な役割を果たしているのが、胃プロトンポンプと呼ばれる、“酸(プロトン、H+)”を胃の中に汲み出す(ポンプする)タンパク質です(図2)。胃プロトンポンプは、胃の表面、胃壁細胞の細胞膜で働いています。酸性度の高い、つまりH+の濃度が高い(pHの低い)胃の内部に向かってH+を輸送することは、濃度勾配に逆らった輸送なのでエネルギーが必要です(能動輸送)。胃プロトンポンプは、細胞内に存在するATP(アデノシン三リン酸、細胞のエネルギー共通通貨とも言われる)をエネルギー源として、胃の中にH+を1つずつ輸送し、反対方向にK+を同じように1つずつ輸送します。このような働きから、別名H+,K+-ATPase(ATPのエネルギーを使ってH+とK+を輸送するタンパク質、という意味)と呼ばれます。
膜タンパク質が輸送するイオンの種類や個数
胃プロトンポンプとよく似たナトリウムポンプは、アミノ酸配列が60%以上同じです。これらのタンパク質はいわば兄弟のような関係ですが、それぞれが輸送するイオンの種類や個数が違います(図3)。
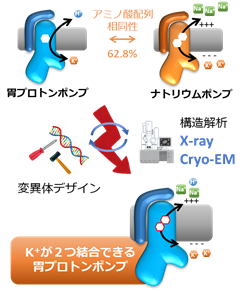
- 胃プロトンポンプ H+ x 1個 ⇔ K+ x 1個
- ナトリウムポンプ Na+ x 3個 ⇔ K+ x 2個
これら2つのイオンポンプは、H+とNa+の違いの他にも、輸送するK+の個数が違います。なぜ、近縁のポンプ間でのこのような違いが生じるのか?という問題は、これらのイオンポンプが発見されて以来、40年以上も未解明の問題です。
研究グループは、K+を1つだけ輸送する胃プロトンポンプからスタートして、K+結合部位を少しずつ変異させ、最終的に5つのアミノ酸を変異させることでK+を2つ結合する変異体を作製することに成功しました(図4)。これを達成するため、途中段階の変異体をX線結晶構造解析注1)や、クライオ電子顕微鏡による単粒子解析注2)によって『タンパク質の構造を視る』ことにより、極小の世界注3)で起こっている変化を観察し、それを少しずつ修正していくことでK+が2つ結合した状態を作り出しました。
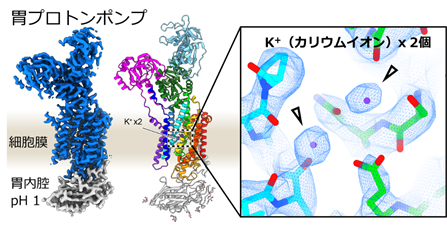
このためには、単純にK+に直接結合するアミノ酸の変異だけでは不十分で、2次的、3次的に結合ポケットの形に関係する変異(2つ)や、分子全体のコンフォメーションに影響を及ぼす変異(1つ)、合計5つの変異が必要でした。この結果は、タンパク質が単純なパーツの組み合わせではなく、機能実現のために分子全体が精密にデザインされていることを示しています。
成果の意義
タンパク質の構造を参考にして、胃プロトンポンプの輸送イオンの個数を人為的に変化させることに成功しました。よく似た2つのイオンポンプがカリウムイオンの個数を識別するしくみが理解できました。
用語説明
- 注1)X線結晶構造解析(X-ray)
- タンパク質の構造解析法の1つ。X線をタンパク質の三次元結晶に照射して回折像を収集し、そのデータをコンピューターによって解析することで、タンパク質の立体構造を得る。

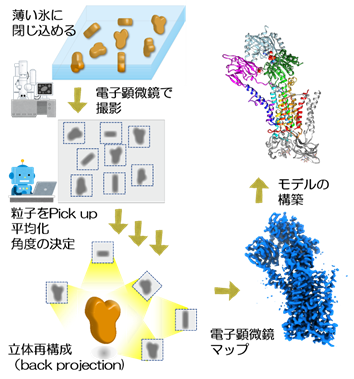
- 注2)クライオ電子顕微鏡による単粒子解析(Cryo-EM)
- タンパク質を薄い氷の中に閉じ込めて、クライオ電子顕微鏡(クライオ=低温という意味)で画像を撮影する。画像には、いろいろな方向を向いたタンパク質が映っているが、それ自体はノイズが多い。コンピューター上で同じ方向を向いている粒子を重ね合わせ、数十万粒子の画像から立体構造を構築する。この方法によって高い解像度でタンパク質の立体構造が得られる。この方法の開発に貢献した3名の研究者が、2017年にノーベル化学賞を受賞した。COVID-19のスパイクタンパクをはじめ、様々なタンパク質の構造に基づいた創薬研究にも世界的に広く利用されている。
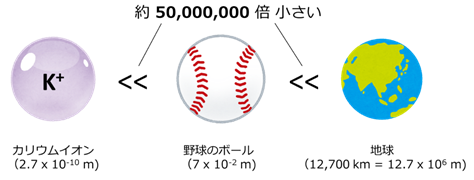
- 注3)極小の世界~イオンの大きさ
- カリウムイオンや、タンパク質の構成成分であるアミノ酸は非常に小さく、「視る」ことが難しい。そのためX線や電子顕微鏡を使った特殊な方法を使う必要がある。カリウムイオンがどれくらい小さいかおおよそ計算すると、下の図のような関係になる。
論文情報
- 雑誌名
- Nature Communications
- 論文タイトル
- Gastric proton pump with two occluded K+ engineered with sodium pump-mimetic mutations
- 著者
- 1,2Kazuhiro Abe, 2,3Kenta Yamamoto, 1,2,4Katsumasa Irie, 5Tomohiro Nishizawa, 1,2Atsunori Oshima
1名古屋大学細胞生理学研究センター、2名古屋大学大学院創薬科学研究科、3(現所属:資生堂株式会社)、4(現所属:和歌山医科大学)、5横浜市立大学大学院生命医科学研究科 - DOI
- 10.1038/s41467-021-26024-1
お問い合わせ先
研究者連絡先
東海国立大学機構名古屋大学大学院細胞生理学研究センター
准教授 阿部一啓(あべ かずひろ)
TEL:052-747-6838 FAX:052-747-6795
E-mail:kabe“AT”cespi.nagoya-u.ac.jp
報道連絡先
東海国立大学機構名古屋大学管理部総務課広報室
TEL:052-789-3058 FAX:052-789-2019
E-mail:nu_research“AT”adm.nagoya-u.ac.jp
AMED事業連絡先
日本医療研究開発機構創薬事業部医薬品研究開発課
創薬等ライフサイエンス研究支援基盤事業(BINDS)
TEL:03-6870-2219
E-mail:20-ddlsg-16“AT”amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
関連リンク
掲載日 令和3年9月30日
最終更新日 令和3年9月30日


