プレスリリース 「iPS細胞由来ナチュラルキラー細胞を用いた卵巣がん治療に関する治験」における第一症例目の移植実施について
プレスリリース
国立大学法人京都大学iPS細胞研究所(CiRA)
国立研究開発法人国立がん研究センター
国立研究開発法人日本医療研究開発機構(AMED)
ポイント
- 卵巣がん患者さんにヒトiPS細胞由来ナチュラルキラー(以下、NK)細胞注1)の細胞移植を実施した
- 京都大学iPS細胞研究財団が提供するiPS細胞ストック注2)の細胞を用いた
- 治験は国立がん研究センター東病院にて継続中
概要
国立大学法人京都大学iPS細胞研究所(以下、CiRA)の金子新教授らの研究グループは、国立研究開発法人国立がん研究センター東病院(以下、国立がん研究センター東病院)と連携し、「抗Glypican3(以下、GPC3)-CAR注3)発現iPS細胞由来ILC/NK細胞注4)(以下、開発名:iCAR-ILC-N101)を腹腔内投与することの安全性及び忍容性を検討する第I相臨床試験」を計画・実施してきました。この度、第一症例目の被験者に対し、iCAR-ILC-N101の腹腔内投与を行いましたのでご報告いたします。
CAR遺伝子導入T細胞(CAR-T細胞)やCAR遺伝子導入NK細胞(CAR-NK)などによるがん免疫療法は、一部のがんに劇的な治療効果を発揮することがわかってきています。CiRAの金子新教授らの研究グループは、これまでにiPS細胞を介した抗原に特異的な再生T細胞や再生NK細胞製剤の開発を進めてきました。特に、HLAホモiPS細胞注5)を用いた再生免疫細胞は、複数の患者さんに使用可能であり、安定供給が見込めます。また、ゲノム編集による免疫細胞の機能強化や細胞疲弊の回避などにも対応できます。
研究グループは、極めてがん特異性の高いタンパク質であるGPC3にまず着目しました。日本人において最頻度のHLAをホモでもつiPS細胞(以下、QHJI01s04)にGPC3を認識するCAR遺伝子を導入し、NK細胞(開発名:iCAR-ILC-N101)へと分化させました。GPC3をよく発現する卵巣明細胞癌を対象として、iCAR-ILC-N101を使用した治験を計画しました。
本年4月から国立がん研究センター東病院にて治験を開始し、本年9月に第一症例目の細胞移植を実施しました。
治験の経過
2021年1月25日 国立研究開発法人国立がん研究センター治験審査委員会より承認
2021年3月12日 独立行政法人医薬品医療機器総合機構(PMDA)を通じて厚生労働大臣へ治験計画届書を提出
2021年4月12日 治験開始
2021年9月 第一症例目 細胞移植実施
治験計画の概要
- 治験名称
「GPC3発現手術不能進行再発卵巣明細胞癌で腹膜播種を有する患者を対象とした、抗GPC3-CAR発現iPS細胞由来ILC/NK細胞を腹腔内投与することの安全性及び忍容性を検討する第I相臨床試験」 - 治験の目的
GPC3発現手術不能進行再発卵巣明細胞癌で腹膜播種病変を有する患者を対象に、iCAR-ILC-N101を腹腔内に反復投与する治療法の安全性、忍容性及び有効性を評価する。 - 治験に使用する細胞
公益財団法人京都大学iPS細胞研究財団にて作製・保存している「QHJI01s04」の遺伝子を改変し、抗GPC3-CARを発現させ、ILC/NK細胞へと分化させた細胞(iCAR-ILC-N101)。 - 対象疾患
GPC3発現手術不能進行再発卵巣明細胞癌で腹膜播種を有する患者さん - 細胞移植について
iCAR-ILC-N101として1回1×106cells/kgを1週間に1回、最大4回にわたり、経皮的に腹腔内に反復投与する。用量依存性の毒性の出現に応じて、最小投与例を1回0.5×106cells/kg×最大4回を22日間で、最大投与例を1回3×106cells/kg×最大4回を22日間で投与する。 - 実施予定人数
6~18人 - 実施期間
2021年4月12日~2024年3月31日 - 治験参加者の募集
詳細は下記、国立がん研究センター東病院ホームページをご覧ください。
国立がん研究センター東病院
研究開発体制
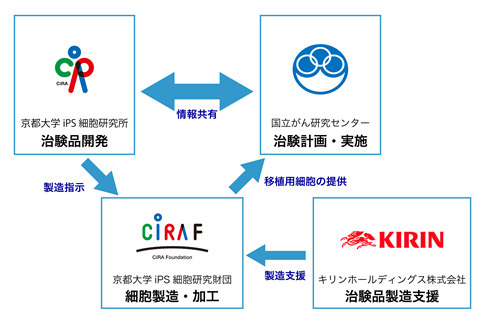
- CiRA
- 主任研究者:金子新 教授
- 治験品開発
- 製造法・品質規格の設定
- 非臨床安全性試験の実施
- 国立がん研究センター
- 治験調整医師:
国立がん研究センター東病院 - 先端医療科/副院長 土井 俊彦 科長(治験調整医師代表)
- 先端医療科/腫瘍内科 原野謙一 医員
- 先端医療科/血液腫瘍科 湯田淳一朗 医員
- 臨床研究支援部門 佐藤暁洋 部門長
- 国立がん研究センター先端医療開発センター
- 免疫療法開発分野 中面哲也 分野長
-
- 医師主導治験計画作成
- 医師主導治験実施
- 京都大学iPS細胞研究財団
-
- 治験品製造受託
- 製造バリデーション
- 分析バリデーション
- キリンホールディングス株式会社
- 治験品製造支援
- 研究実施体制
-
本治験への支援
本研究は、下記機関より支援を受けて実施されています。
- 国立研究開発法人日本医療研究開発機構(AMED)革新的がん医療実用化研究事業
2019年度~2021年度「GPC3発現手術不能進行・腹膜播種卵巣明細胞腺癌を対象としたヒト同種iPS細胞由来GPC3-CAR再生自然キラーリンパ球(ILC/NK)の安全性、忍容性および薬物動態を検討する第Ⅰ相臨床試験」(研究開発代表者:金子新)
用語説明
- 注1)ナチュラルキラー(NK)細胞
- 免疫においてはたらく細胞の一種。NK細胞は抗原特異的な免疫反応を示さず、非特異的に細胞を傷害するといった免疫反応(自然免疫)をする。
- 注2)iPS細胞ストック
- HLAホモ接合体の細胞を有する健康なドナーからiPS細胞を作製し、あらかじめ様々な品質評価を行った上で、再生医療に使用可能なiPS細胞株を保存するプロジェクト。平成25年にCiRAで開始し、現在は京都大学iPS細胞研究財団が引き継いでいる。7名のドナーから27株のiPS細胞を製造・保存しており、日本人の約40%をカバーすることができる。ゲノム編集により更に多くの人をカバーできるiPS細胞の提供を目指している。
- 注3)CAR(キメラ抗原受容体、Chimeric antigen receptor)
- 特定のタンパク質を持つがん細胞に結合することができる人工的に作られた受容体。免疫細胞の一種であるT細胞やNK細胞に導入されると、T細胞やNK細胞が特定のタンパク質を持つがん細胞を発見し、攻撃するようになる。
- 注4)ILC/NK細胞(自然免疫キラーリンパ球)
- ILC(自然リンパ球)は、通常のTリンパ球と対比して説明されることの多い免疫細胞集団で、Tリンパ球の各サブセットと同様のマスター転写因子を発現し、サイトカイン等による抗原非依存的な刺激によってTリンパ球の各サブセットと同様のサイトカインプロファイルを示すことが知られる。CD8キラーT細胞、I型CD4ヘルパーT細胞、Ⅱ型CD4ヘルパーT細胞、17型CD4ヘルパーT細胞のそれぞれが機能的に、自然リンパ球のNK細胞、1型ILC、2型ILC、3型ILCに相当すると考えられる。
ILC/NKは研究グループによる呼称で、ILCのうち特にNK細胞に相当する細胞を示す。 - 注5)HLAホモiPS細胞
- HLAとはヒトの主要組織適合遺伝子複合体(MHC)であるヒト白血球型抗原(Human Leukocyte Antigen)の略で、細胞の自他を区別する型。ヒトの免疫に関わる重要な分子として働く。父親と母親から同じHLA型の遺伝子を受け継いだドナーから作成されたiPS細胞。このiPS細胞から作製した細胞を移植する際に、移植できる人が多いと考えられる。
お問い合わせ先
研究・報道に関すること
国立大学法人京都大学iPS細胞研究所(CiRA)
国際広報室
和田濵
TEL:075-366-7005 FAX:075-366-7185
E-mail:media“AT”cira.kyoto-u.ac.jp
国立研究開発法人国立がん研究センター
企画戦略局 広報企画室(柏キャンパス)
TEL:04-7133-1111(代表) FAX:04-7130-0195
E-mail:ncc-admin“AT”ncc.go.jp
AMED事業に関すること
国立研究開発法人日本医療研究開発機構(AMED)
再生・細胞医療・遺伝子治療事業部
遺伝子治療研究開発課
革新的がん医療実用化研究事業事務局
E-mail:cancer“AT”amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
関連リンク
掲載日 令和3年11月11日
最終更新日 令和3年11月11日


