プレスリリース B型肝炎ウイルスの複製を抑制する宿主防御メカニズムを分子レベルで解明―ウイルスタンパク質の排除にオートファジーが関わる―
プレスリリース
横浜市立大学
日本医療研究開発機構
横浜市立大学大学院医学研究科 微生物学 梁 明秀教授、宮川 敬准教授らの研究グループは、国立感染症研究所、国立国際医療研究センター研究所などとの共同研究で、B型肝炎ウイルス(HBV)感染細胞におけるウイルスの増殖抑制に、インターフェロン誘導性タンパク質であるガレクチン-9(GAL9)*1が関わっていることを発見しました。GAL9は、HBVタンパク質をオートファジー*2と呼ばれる仕組みで分解するユニークな因子です。
現在、慢性B型肝炎の治療としてインターフェロン投与が行われていますが、その詳細な作用メカニズムは十分に研究されていません。今回明らかになった仕組みは、今後HBVを駆除する新しい治療法につながることが期待されます。
本研究成果は、シュプリンガー・ネイチャーが発行する学際的なオープンアクセス・ジャーナルの『Nature Communications』に掲載されました。(日本時間2022年1月27日19時)
研究成果のポイント
- 慢性B型肝炎の治療として、インターフェロン投与が行われているが、その詳細な作用機序は十分に解明されていない。
- B型肝炎ウイルスコアタンパク質(HBc)に作用する分子として、インターフェロンにより誘導されるタンパク質であるガレクチン-9(GAL9)を見出した。
- GAL9を中心としたHBcに対する選択的オートファジーが、ウイルスの複製防止と増殖抑制に寄与することを明らかにした。
- GAL9により誘導される抗ウイルス活性を増強する戦略は、慢性B型肝炎の効果的な治療法の開発に応用できる。
研究の背景
世界保健機関の報告によると、世界中で約20億人がB型肝炎ウイルス(HBV)に感染していると推計されており、そのうち2億4,000万人以上が肝硬変や肝細胞がんに進行するリスクのある慢性B型肝炎に罹患しています。現在、慢性B型肝炎に対する核酸アナログ製剤による治療法は、肝硬変や肝細胞がんへの進行を防ぐことを目的としており、HBVそのものを排除することは難しいとされています。また、核酸アナログ製剤による治療が長期におよぶと副作用のリスクが高くなるとともに、薬剤耐性ウイルスが出現し、治療の失敗と病気の進行につながる可能性があります。したがって、これらの課題を克服した新たな抗ウイルス療法が待ち望まれています。
慢性B型肝炎の治療法の一つが、インターフェロン投与(IFN療法)です。ウイルス増殖抑制効果が強く、免疫を活性化する作用もあるため、古くから慢性B型肝炎の治療に使われてきました。しかしIFNによるウイルス抑制のメカニズムについては十分に解明されていませんでした。そこで研究チームでは、HBV増殖抑制に重要な役割を果たすIFN誘導性タンパク質の同定とそのメカニズムの解明に挑みました。
研究内容
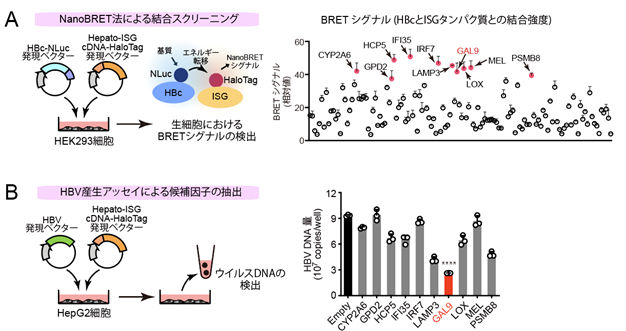
ヒト肝細胞においてI型IFNによって特異的に発現が誘導される130のインターフェロン刺激遺伝子(Interferon Stimulatory genes:ISG、ここでは「hepato-ISG」と呼ぶ)のcDNAライブラリーを作成し、生物発光共鳴エネルギー伝達法(BRET法)*3を用いて、HBVのコアタンパク質(HBc)と結合する遺伝子産物をスクリーニングしました(図1A)。その結果、10種類のhepato-ISGタンパク質がHBcと相互作用し、そのうち、ガレクチン-9(以下GAL9)と呼ばれるタンパク質がHBVの放出を著しく減少させることがわかりました(図1B)。
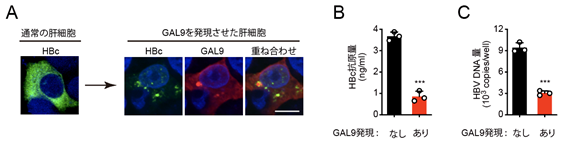
GAL9を肝細胞において発現させたところ、GAL9とHBcは細胞内に斑点状に凝集しました(図2A)。さらにこのような細胞では、HBVの複製が顕著に低下していました(図2B、2C)。この凝集体を調べたところ、別の抗ウイルス因子であるViperinやユビキチンリガーゼRNF13、オートファジー受容体p62などが含まれることが分かりました。
GAL9による抗HBV作用について詳しく解析した結果、GAL9はまずViperinを介してHBcと結合し、RNF13がリクルートされ、そのユビキチン化を促進していました。このユビキチン鎖にp62がリクルートされ、オートファジーが開始されることが分かりました(図3)。
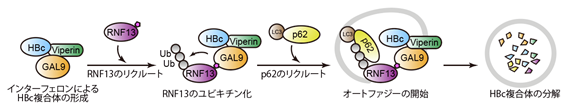
GAL9とViperinの両方がI型IFNによって誘導されることから、HBVに感染した肝細胞では、これらの因子がIFN依存性のHBc分解に相乗的に作用していることがわかりました。また、この機構はヒトが本来もつ宿主防御機構の一部であると考えられます。ウイルス感染における自然免疫系と選択的オートファジーのクロストークが、HBVタンパク質の排除に重要な役割を果たしていることが明らかになりました。
今後の展開
本研究で発見した、GAL9により誘導される抗ウイルス活性を増強する戦略により、HBVに対する新たな治療介入を可能にすることが期待されます。さらに、比較的長い期間の慢性感染において、HBVがIFNによって誘導される宿主の免疫応答を回避するメカニズムを分子レベルで詳細に解明することで、既存の抗ウイルス療法と組み合わせてHBVを排除するための、より効果的な治療戦略の提案を行うことが可能になると考えられます。
研究費
本研究は、国立研究開発法人日本医療研究開発機構(AMED)肝炎等克服実用化研究事業B型肝炎創薬実用化等研究事業「B型肝炎ウイルスの感染複製増殖機構解明による創薬基盤形成に関する研究」および、「レポーターHBVを駆使したHBV複製解析および創薬研究」の支援を受けて実施されました。
論文情報
- タイトル
- Galectin-9 restricts hepatitis B virus replication via p62/SQSTM1-mediated selective autophagy of viral core proteins
- 著者
- Kei Miyakawa, Mayuko Nishi, Michinaga Ogawa, Satoko Matsunaga, Masaya Sugiyama, Hironori Nishitsuji, Hirokazu Kimura, Makoto Ohnishi, Koichi Watashi, Kunitada Shimotohno, Takaji Wakita, and Akihide Ryo
- 掲載雑誌
- Nature Communications
- DOI
- 10.1038/s41467-022-28171-5
用語説明
- *1 ガレクチン-9(GAL9)
- ガレクチン(Galectin)はN-アセチルラクトサミンを特異的に認識して結合する糖鎖結合タンパク質で、哺乳動物においては14種類のガレクチンから成るファミリーを形成し、それぞれ1つまたは2つの糖鎖認識ドメイン(Carbohydrate Recognition Domains:CRD)を有している。
- *2 オートファジー
- 細胞内に形成される膜が内部の物質を空間ごと取り込んで分解する現象。ミトコンドリアなどの細胞小器官や、細菌など特定の物質を選択的に分解する現象のことを「選択的オートファジー」という。
- *3 生物発光共鳴エネルギー伝達法(BRET法)
- ルシフェラーゼタンパク質などの発光物質が光を放出するために使うエネルギーを、近くにある蛍光物質に移動させる現象で、タンパク質間の相互作用を蛍光増加として検出することができる。
お問い合わせ先
取材対応に関する窓口
横浜市立大学 広報課長 上村一太郎
Tel:045-787-2414 E-mail:koho"AT"yokohama-cu.ac.jp
AMED事業に関する窓口
国立研究開発法人日本医療研究開発機構(AMED)
疾患基礎研究事業部 疾患基礎研究課
肝炎等克服実用化研究事業
Tel:03-6870-2225 E-mail:hepatitis"AT"amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
関連リンク
掲載日 令和4年1月28日
最終更新日 令和4年1月28日


