プレスリリース チャネル(膜タンパク質)の開閉モデルの提唱―チャネルの通路を塞ぐ「脂質」が深く影響―
プレスリリース
東海国立大学機構名古屋大学
日本医療研究開発機構
国立大学法人東海国立大学機構 名古屋大学細胞生理学研究センター・大学院創薬科学研究科・糖鎖生命コア研究所の大嶋 篤典教授は、名古屋大学トランスフォーマティブ生命分子研究所のタマ フロハンス教授、三重大学、大阪大学、東京大学、東京医科歯科大学、日本電子株式会社らとの共同研究で、ATP(アデノシン三リン酸)放出チャネル(膜タンパク質)として知られるパネキシン1が、脂質に埋まった状態のクライオ電子顕微鏡構造を報告しました。本研究により、ATPなどイオンよりも大きな分子を通すチャネルの開閉に、脂質が深く関わる可能性が示唆されました。
チャネルタンパク質パネキシン1は、ATPや代謝産物などのイオンよりもはるかに大きい分子を通すことから「large pore channel」と呼ばれていますが、パネキシン1の開閉メカニズムは厳密に理解されていませんでした。
本研究では、脂質二重膜に再構成したパネキシン1の構造が、2つの異なる状態で得られ、チャネルの通路に脂質が埋まって通路を塞ぐことでチャネルを閉じる開閉モデルを提唱しました。パネキシン1が開くと、炎症やガンの増殖、てんかんといった症状が引き起こされます。本研究成果は、パネキシン1の開閉メカニズムの理解につながるもので、パネキシン1を原因とする症状に対する治療法や医薬品の開発が期待されます。
本研究成果は、2022年2月9日午前4時(日本時間)付アメリカ学術雑誌「Science Signaling」に掲載されました。
本研究は、文部科学省科学研究費補助金「基盤研究B」「挑戦的研究(萌芽)」、日本医療研究開発機構(AMED)「創薬等ライフサイエンス研究支援基盤事業・創薬等先端技術支援基盤プラットフォーム(BINDS)」、内藤記念科学振興財団助成金、大幸財団自然科学系学術研究助成の支援のもとで行われたものです。
ポイント
- ATP(アデノシン三リン酸)放出に関わる、パネキシン1の構造と機能の研究。
- チャネルの通路を脂質が塞ぐと同時に、アミノ末端領域が大きく構造変化。
- 脂質がチャネルタンパク質の隙間を縫うようにして移動する可能性を示唆。
研究背景と内容
細胞膜にあるチャネルと呼ばれる膜タンパク質には、特定のイオンを選択的に通す径の小さい通路を持つもののほかに、イオンやセカンドメッセンジャーを含むヌクレオチド、アミノ酸、ペプチドなどを非選択的に通す径の大きな通路を持つ「large pore channel」と呼ばれるものがあります。ヒトに存在するパネキシン1は後者に属し、このチャネルが開くと、生体レベルでは、炎症反応やてんかんを引き起こすことが知られており、細胞レベルでは、がん細胞の増殖や神経細胞死に関わるとされています。一部のがん細胞では、パネキシン1の発現の増加が見られていることから、パネキシン1のチャネル活性を制御することは、がんの治療にも役立つ可能性があります。
生物の細胞は細胞膜に囲まれており、脂質は細胞膜を構成する主要な要素です。パネキシン1は膜タンパク質で、細胞膜に埋まった状態で機能しています。これまで、脂質に埋まった状態で、ヒトのパネキシン1の構造変化を示すものはありませんでした。
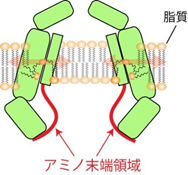
本研究では、ナノディスク再構成法注1)という手法で、パネキシン1を脂質に埋め込んだディスク粒子を作製し、その試料をクライオ電子顕微鏡法注2)で構造解析しました。その結果、通常の精製条件では、パネキシン1のアミノ末端領域が、チャネルの通路内側で漏斗状の構造を取って通路を大きく開いている(図1)一方で、精製時にパネキシン1の阻害剤を添加した条件では、アミノ末端領域が細胞質側に向くと同時に、脂質がチャネルの通路内側に存在し、チャネルの通路がブロックされた構造が得られました(図2)。電気生理学実験注3)では、この阻害剤がチャネルの活性を低下させることが確認され、阻害剤が入った条件の構造は、チャネルが閉じていることを示唆するものでした。パネキシン1は、7つのサブユニット注4)が集まってチャネルを形成しますが、得られた構造では、隣接するサブユニットの隙間に脂質が存在しており、MDシミュレーション注5)の結果、サブユニットの隙間に脂質が入り込んだり、抜け出る様子が観察されました。これは、脂質がチャネルタンパク質の隙間を縫うようにしてチャネルの通路に出入りする可能性を示しており、パネキシン1の開閉機構として、脂質がパネキシン1と相互作用しながらチャネル通路内へ移動する「脂質ゲーティングモデル」(図3)を支持するものです。
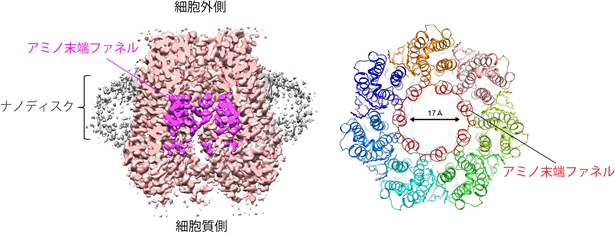
(右)原子構造のリボンモデルを細胞質側から見た図。この中央がチャネルの通路となる。
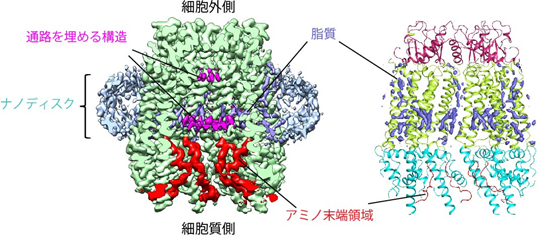
脂質がチャネルの通路に入り込んでいる。
成果の意義
パネキシン1を含めた「large pore channel」と呼ばれる膜タンパク質チャネルは複数存在しますが、直径が10Å(オングストローム)を超えるような通路の広さを持つチャネルがイオン一つ通さないクローズ状態をどのように実現するのかは、よくわかっていません。
今回の研究は“脂質がパネキシン1の通路に入り込んで密閉する”という開閉モデルの概念を提示するものです。これと同様の考え方は、私たちがギャップ結合チャネルのイネキシン6で報告したほか、数例類似した報告があります。脂質と膜タンパク質の関係は切っても切れない関係にあり、チャネルを含めた膜タンパク質の本質的な機能を理解するために、脂質に埋まった状態で膜タンパク質を構造解析する重要性は、今後も高まるものと考えられます。
用語説明
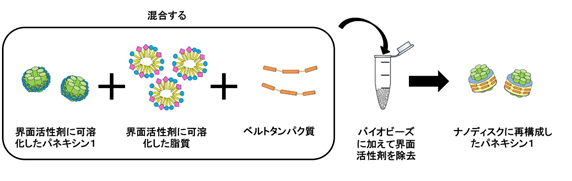
- 注1)ナノディスク再構成法
- ナノディスクとは、膜タンパク質が脂質に埋まり、周囲をベルトタンパク質で囲んで粒子状になったものをいう。通常、膜タンパク質を精製する時、界面活性剤で可溶化するため、脂質は取り除かれてしまう。可溶化した膜タンパク質と脂質、ベルトタンパク質の3つを適切な割合で混合し、界面活性剤を除去すると、膜タンパク質が脂質に再構成した状態のナノディスクを作製できる。
- 注2)クライオ電子顕微鏡法
- 生体高分子(ここではパネキシン1)をガラス状の氷に埋め込んで、電子顕微鏡写真を撮影し、構造解析する方法。クライオとは極低温を意味し、この研究では液体窒素温度(-196℃)付近で観察した。タンパク質試料を結晶化する必要がなく、タンパク質の高分解能構造解析の手法として、世界中で広く利用されている。
- 注3)電気生理学実験
- チャネルタンパク質において、そのイオンの透過を電気信号として測定する技術や実験手法。細胞膜に電極を刺して電圧を印加し、電極を介して流れる電流を測定する。
- 注4)サブユニット
- タンパク質の複合体に含まれる単一のポリペプチド。パネキシン1の場合、7つのパネキシン1ポリペプチドがリング状に集合して、一つの完全なチャネルを形成する。この時集まっているパネキシン1ポリペプチド一つ一つをサブユニットという。
- 注5)MDシミュレーション = molecular dynamics simulation
- 分子の動的な構造変化を計算機で追跡する手法。分子力場を用いて、分子を構成する 各原子に働く力を求め、これを用いてニュートンの運動方程式を解き、原子の軌跡を決定する。
論文情報
- 雑誌名
- Science Signaling
- 論文タイトル
- Structures of human pannexin-1 in nanodiscs reveal gating mediated by dynamic movement of the N-terminus and phospholipids
- 著者
- Maki Kuzuya1, Hidemi Hirano2, Kenichi Hayashida2, Masakatsu Watanabe3, Kazumi Kobayashi4, Tohru Terada5, Md. Iqbal Mahmood6, Florence Tama6,7,8, Kazutoshi Tani9, Yoshinori Fujiyoshi10,11 and Atsunori Oshima1,2,12
- 所属
- 1 名古屋大学大学院創薬科学研究科
2 名古屋大学細胞生理学研究センター
3大阪大学大学院生命機能研究科
4 日本電子株式会社
5 東京大学大学院農学生命科学研究科
6 名古屋大学大学院理学研究科
7 名古屋大学トランスフォーマティブ生命分子研究所
8 理化学研究所 計算科学研究センター
9 三重大学医学系研究科
10 東京医科歯科大学高等研究院
11 株式会社CeSPIA
12 名古屋大学糖鎖生命コア研究所 - DOI
- 10.1126/scisignal.abg6941
お問い合わせ先
研究内容に関すること
東海国立大学機構
名古屋大学細胞生理学研究センター・大学院創薬科学研究科・糖鎖生命コア研究所
教授 大嶋 篤典(おおしま あつのり)
TEL:052-747-6837 FAX:052-747-6795
E-mail:atsu”AT”cespi.nagoya-u.ac.jp
報道に関すること
東海国立大学機構 名古屋大学管理部総務課広報室
TEL:052-789-3058 FAX:052-789-2019
E-mail:nu_research”AT”adm.nagoya-u.ac.jp
AMED事業に関すること
日本医療研究開発機構(AMED)
創薬等ライフサイエンス研究支援基盤事業(BINDS)
創薬事業部 医薬品研究開発課
TEL:03-6870-2219
E-mail:20-DDLSG-16”AT”amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
関連リンク
掲載日 令和4年2月9日
最終更新日 令和4年2月9日


