プレスリリース 完全ヒト抗体産生マウスの作製に成功―ヒトのレパトアを再現・抗体医薬品創出へ期待―
プレスリリース
鳥取大学
日本医療研究開発機構
ポイント
- これまでに抗体注1)医薬創出のために、染色体導入技術を用いてヒト抗体産生マウスが作製されていたが、ヒト抗体遺伝子を含むヒト染色体の安定性は完全でなく、その安定化により、さらに高性能なヒト抗体産生マウスの作製が可能であると考えられた。
- 独自の染色体工学技術を用いて、ヒト抗体遺伝子全長を安定に保持するマウスの作製に成功し、このマウスがヒトに類似した多様な抗体レパトア注2)を再現していることを明らかにした。
- 免疫することにより、抗原特異的な抗体が効率よく取得できることから、本ヒト抗体産生マウスは安全性の高いヒト抗体医薬品の創出に役立つことが期待される。
概要
鳥取大学医学部生命科学科/染色体工学研究センター 香月 康宏准教授、里深 博幸准教授、森脇 崇史助教、阿部 智志研究員らのグループは、独自の染色体工学技術を用いて、新たなヒト抗体産生マウスの作製に成功しました。
これまでの染色体導入ヒト抗体産生マウスは、ヒト抗体遺伝子を含むヒト染色体の安定性が完全ではなく、さらなる高性能化が必要でした。本研究グループは、独自の染色体工学技術を用いて、マウス人工染色体(MAC)にヒト抗体遺伝子全長を搭載することにより、巨大なヒト抗体遺伝子を安定に保持するマウス系統の樹立に成功しました。
このマウスは、ヒトに類似した多様な抗体遺伝子レパトアを示し、このマウスを抗原で免疫をした際、抗原特異的モノクローナル抗体注3)の取得効率が高いことが分かりました。
本研究成果はヒト免疫応答の解明および安全な抗体医薬品の創出に貢献するものと期待できます。
本研究は、株式会社Trans Chromosomics、九州大学および東京薬科大学などとの共同研究で行いました。
本研究成果は、2022年4月5日18時(日本時間)に「Nature communications」のオンライン版で公開されました。
研究支援
本成果は、以下の事業の支援を受けて実施しました。
- AMED創薬等ライフサイエンス研究支援基盤事業(BINDS)「人工染色体技術を用いたヒト化マウス/ラットおよび多機能細胞による創薬支援」(補助事業代表者:香月康宏)
- AMED革新的バイオ医薬品創出基盤技術開発事業「染色体工学技術を用いたヒト抗体産生ラットの作製」(研究開発代表者:香月康宏)
- JST戦略的創造研究推進事業(CREST)「ヒト/マウス人工染色体を用いたゲノムライティングと応用」(研究開発代表者:香月康宏)
- AMED革新的先端研究開発支援事業「免疫系ヒト化動物を活用した抗感染症ヒト抗体創成基盤の確立」(研究開発代表者:冨塚一磨)
研究の背景と経緯
2022年現在、医薬品世界売上ベスト10の半数以上が抗体医薬品という事実に象徴されるように、Kohler & Milsteinによるモノクローナル抗体取得技術の開発から約40年、癌/感染症/自己免疫疾患等幅広い疾患の治療における抗体医薬品の存在感はますます大きくなっています。歴史を振り返れば、抗体医薬の実用化における最大の障壁は、通常はマウス由来であるモノクローナル抗体のヒトに対する免疫原性でした。この問題を解決するため、ヒト抗体を産生するトランスジェニック(Tg)マウス注4)が様々なアカデミアや企業から開発されてきました。
一方、1Mbを超える巨大なヒトIg遺伝子全長のマウスへの導入は、従来のTg作製法では困難であり、ヒトで観察されるものと同様に多様なヒト抗体レパトアをマウスで再現するには、各Ig(重鎖:1.8Mb、軽鎖κ:1.7Mb、軽鎖λ:2.2Mb)遺伝子の全長をマウスに導入することが望ましいと考えられてきました。本研究グループは2000年、トランスクロモソミック(TC)マウス作製技術により無傷のヒトIg遺伝子座を保持しヒト抗体を産生するマウス作製に世界で初めて成功しましたが、ヒト抗体遺伝子座を含むヒト由来のセントロメア注5)配列を持つヒト染色体のマウスにおける安定性は完全でなく、その安定化により更に高性能化できると考えてきました。
研究の内容
本研究グループは染色体レベルでの遺伝子導入等、本研究の基盤となる染色体導入(トランスクロモソミック)マウス作製技術を世界に先駆けて開発してきました。さらに、独自の染色体工学技術によりマウス人工染色体(MAC: mouse artificial chromosome)ベクターの開発に成功してきました。新規の遺伝子導入ベクターであるMACベクターの特徴は、1)全ての遺伝子を取り除いてあり、新たな任意の遺伝子を搭載でき、2)宿主染色体に挿入されず独立して維持され、マウスおよびラットで子孫伝達ができ、3)マウス・ラットを含む哺乳類細胞において一定のコピー数で長期間安定に保持され、4)導入可能なDNAの長さの制限がありません。以上のことから、MACベクターを用いた遺伝子導入は従来法であるノックアウト(KO)注6)、ノックイン(KI)注7)、トランスジェニック(Tg)作製方法では不可能であった多くの応用を可能にする点で世界でも類をみない独創的なアプローチです。上記の技術開発が本研究のブレークスルーのポイントとなりました。
本研究では、独自の染色体工学技術を用いて、Ig遺伝子座(重鎖:1.8Mb、軽鎖κ:1.7Mb)の全長合計3.5Mbを上述のMACベクターにクローニングし、内在性のマウス抗体遺伝子座が破壊されたマウスに導入することに成功しました。すなわち、天然のヒト抗体重鎖、軽鎖遺伝子座全長を安定的に保持し、ヒト抗体を産生する完全ヒト抗体産生マウスの作製に世界で初めて成功したことになります(TC-mAbマウスと命名)(図1)。さまざまな解析の結果、上記TC-mAbマウスではヒトで観察されるヒト抗体レパトア(多様性)を再現しており、その多様性に重要なVDJ配列の使用頻度やCDR3長もヒトとの類似性が高いことが分かりました(図2)。これまでTC-mAbマウスほどヒトの抗体生産を再現した性質を持つヒト化マウスの例はないことから、天然のヒト抗体遺伝子座全体を安定に導入する重要性が明らかとなりました。さらに、TC-mAbマウスを抗原で免疫した際、抗原特異的モノクローナル抗体の取得効率が高い利点があることが分かりました(図3)。このことは正常マウスに比べて望みの抗原に対するモノクローナル抗体を取得しやすくなることを意味しています。
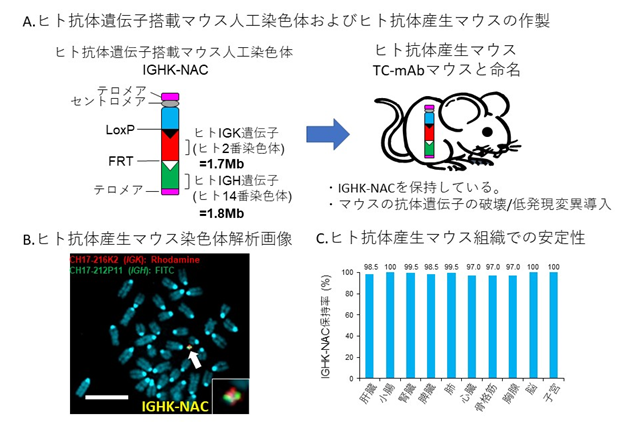
- ヒト抗体産生マウス作製に用いた完全長ヒト抗体遺伝子搭載マウス人工染色体の構造を示した。LoxPおよびFRTといった組換え配列を用いてマウス人工染色体にヒト2番染色体上のIGK遺伝子領域およびヒト14番染色体上のIGH遺伝子領域を連結している(IGHK-NAC)。染色体移入法によりIGHK-NACをマウスES細胞へ移入し、キメラマウス作製、子孫伝達後、交配によりヒト抗体産生マウス(TC-mAbマウス)を作製した。
- ヒト抗体産生マウスの骨髄細胞のFISH解析(染色体解析)画像。マウス染色体の中に、IGHK-NACが1本独立して存在していることが分かる。赤色シグナルはIGK遺伝子領域、緑色シグナルはIGH遺伝子領域を検出している。
- FISH解析によるヒト抗体産生マウスの各組織におけるIGHK-NAC保持率解析結果。ヒト抗体遺伝子搭載マウス人工染色体がヒト抗体産生マウス各組織において非常に安定に保持されることが示された。
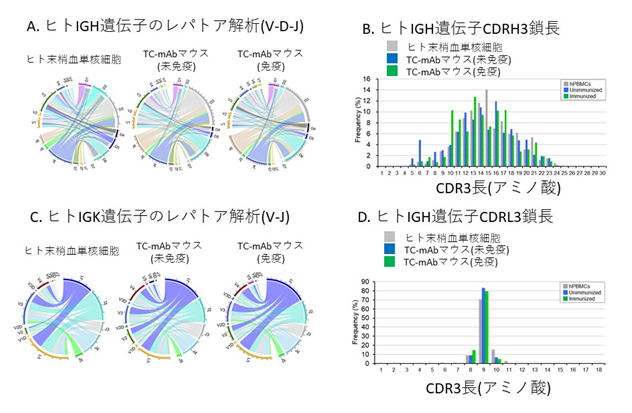
- ヒトIGH遺伝子のレパトア解析結果。CircosプロットでVDJの関連性を示している。遺伝子のセグメントはサブファミリーにグループ化されており、アレルの名前の最初の文字が一緒に表示されている。リンクは特異的なVDJの組み合わせの相対使用頻度を示しており、幅が広いと高い組換え頻度を示している。ヒト末梢血単核細胞と免疫および未免疫TC-mAbマウスの結果は類似している。
- IGH遺伝子配列の中でも抗原と接する重要な領域であるCDR3配列の長さを示しており、ヒトと同様な分布であることがわかる。
- ヒトIGK遺伝子のレパトア解析結果。CircosプロットでVJの関連性を示している。IGH遺伝子同様ヒト末梢血単核球細胞と免疫および未免疫TC-mAbマウスの結果は類似している。
- IGK遺伝子の中でも抗原と接する重要な領域であるCDR3配列の長さを示しており、ヒトと同様な分布であることが分かる。
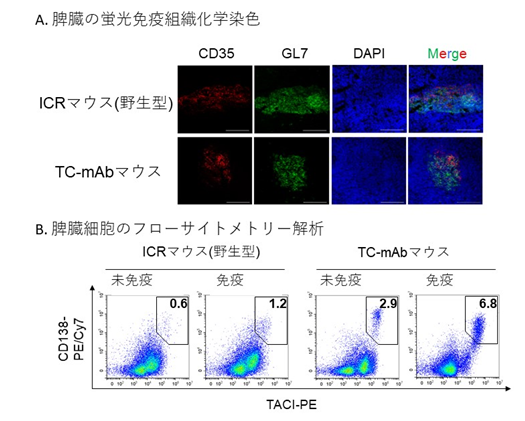
- モノクローナル抗体産生のために繰り返し免疫を行った完全ヒト抗体産生マウスの脾臓の蛍光免疫組織化学染色画像である。免疫応答の際に二次免疫組織に作られる微小構造である胚中心(GC:Germinal center)の形成が確認できる。CD35は濾胞樹状細胞を、GL7はGC B細胞を検出しており、明領域にてB細胞が成熟していることが分かる。
- 未免疫および免疫マウスにおける脾臓細胞のフローサイトメトリー解析結果。CD138およびTACI陽性細胞はプラズマブラスト/プラズマ細胞であり、免疫後にこれら細胞の割合が高いことは野生型マウスよりも効率的な抗原特異的抗体産生を示唆する結果である。
以上のことから、TC-mAbマウスは、安全性の高いヒト抗体医薬品シーズの作製に活用できます。さらに、ヒトで生み出される抗体の多様性をマウスで再現できることを利用して、ヒト免疫応答のモデル動物としての有用なプラットフォームになることが期待されます。
今後の展開
抗体そのもの、あるいは抗原結合部位のみを含むタンパク質断片(scFv等)は今後も次世代バイオ医薬品の重要な素材・構成要素であり続けると考えられています。本研究で開発したTC-mAbマウスのようなツールは多くの研究者が利用できてこそ、その価値が最大化されますが、既存のヒト抗体産生マウスはこれまで一部の企業に独占されていたため、実際に研究者が入手することは困難な状況でした。本研究の成果であるTC-mAbマウスは国内外の公的研究機関に広く提供し、革新的なバイオ医薬品の創成に繋がることが期待されます。こうした取り組みは日本が遅れを取っているバイオ医薬品開発の国際競争力向上をもたらし、癌/感染症/自己免疫疾患などの幅広い疾患に対して、画期的な治療法の提供が可能となることが期待されます。
用語解説
- 注1) 抗体
- 異物である特定の抗原に特異的に結合して、その異物を身体から排除するタンパク質。
- 注2)レパトア
- 抗体遺伝子の機能的な可変領域のもつ多様性。抗原認識の多様性を指す。
- 注3)モノクローナル抗体
- 一種類の単一な抗体という意味。
- 注4)トランスジェニック(Tg)マウス
- 遺伝子導入技術を応用して、ある特定の遺伝子をマウス受精卵などの細胞に注入し、注入された遺伝子情報がその個体の遺伝情報に取り込まれたマウスをいう。
- 注5)セントロメア
- 細胞分裂の際、紡錘糸が結合する染色体分配に重要な染色体領域である。テロメア:染色体の末端にある構造で、染色体の安定性を保つ働きをしている。
- 注6)ノックアウト(KO)
- ある特定のタンパク質をコードする遺伝子を、遺伝子工学的な手法を用いて特異的に欠損させること。
- 注7)ノックイン(KI)
- 標的とする特定の領域にのみ目的遺伝子配列を挿入する方法。ランダム挿入による過剰発現がなく、変異の効果のみを検証可能である。
論文情報
- 発表雑誌
- Nature communications
- 論文タイトル
- “Efficient human-like antibody repertoire and hybridoma production in trans-chromosomic mice carrying megabase-sized human immunoglobulin loci”
(メガベースサイズのヒト免疫グロブリン遺伝子座を保有するトランスクロモソミックマウスにおける効率的なヒト様抗体レパトアおよびハイブリドーマ産生) - 著者
- Hiroyuki Satofuka1*, Satoshi Abe1,2*, Takashi Moriwaki1,3*, Akane Okada1, Kanako Kazuki1, Hiroshi Tanaka2, Kyotaro Yamazaki4, Genki Hichiwa1,3, Kayoko Morimoto2, Haruka Takayama2, Yuji Nakayama5, Shinya Hatano6, Yutaro Yada6, Yasufumi Murakami7, Yoshihiro Baba6, Mitsuo Oshimura2, Kazuma Tomizuka8, and Yasuhiro Kazuki1,3,4†
(*:筆頭著者、†:責任著者) - 所属
- 1Chromosome Engineering Research Center, Tottori University, 86 Nishi-cho, Yonago, Tottori 683-8503, Japan.
2Trans Chromosomics Inc., 86 Nishi-cho, Yonago, Tottori 683-8503, Japan.
3Division of Genome and Cellular Functions, Department of Molecular and Cellular Biology, School of Life Science, Faculty of Medicine, Tottori University, 86 Nishi-cho, Yonago, Tottori 683-8503, Japan.
4Biomedical Science, Institute of Regenerative Medicine and Biofunction, Graduate School of Medical Science, Tottori University, 86 Nishi-cho, Yonago, Tottori 683-8503, Japan.
5Division of Radioisotope Science, Research Initiative Center, Organization for Research Initiative and Promotion, Tottori University, Yonago 683-8503, Japan.
6Division of Immunology and Genome Biology, Department of Molecular Genetics, Medical Institute of Bioregulation, Kyushu University, Higashi-ku, Fukuoka 812-8582, Japan.
7Order-made Medical Research Inc., 5-4-19 Kashiwanoha, Kashiwa, Chiba 277-0882, Japan.
8Laboratory of Bioengineering, Tokyo University of Pharmacy and Life Sciences, 1432-1 Horinouchi, Hachioji, Tokyo 192-0392, Japan. - DOI
- 10.1038/s41467-022-29421-2
お問い合わせ先
研究に関すること
香月 康宏(カヅキ ヤスヒロ)
鳥取大学 医学部生命科学科/染色体工学研究センター 准教授
〒683-8503 鳥取県米子市西町86
Tel:0859-38-6219 Fax:0859-38-6210
E-mail:kazuki”AT”tottori-u.ac.jp
報道に関すること
鳥取大学 米子地区事務部総務課広報係
〒683-8503 鳥取県米子市西町86番地
Tel:0859-38-7037 Fax:0859-38-7029
E-mail:me-kouhou”AT”adm.tottori-u.ac.jp
AMED事業に関すること
日本医療研究開発機構(AMED)
創薬等ライフサイエンス研究支援基盤事業(BINDS)
創薬事業部 医薬品研究開発課
Tel:03-6870-2219
E-mail:20-DDLSG-16”AT”amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
関連リンク
掲載日 令和4年4月6日
最終更新日 令和4年4月6日


