プレスリリース 母親ゲノムの記憶が胎児を育む―胎盤と胚発生に重要な刷り込み遺伝子を同定―
プレスリリース
理化学研究所
日本医療研究開発機構
理化学研究所(理研)生命医科学研究センター融合領域リーダー育成プログラムの井上梓上級研究員、バイオリソース研究センター遺伝工学基盤技術室の的場章悟専任研究員らの共同研究グループは、マウスを用いて、胎仔の発生に重要な刷り込み遺伝子[1]を複数同定しました。
本研究成果は、受精卵にゲノム変異がなくても発生異常が起こる原因の一つを解明したものであり、将来的に不妊症の原因解明につながると期待できます。
子の遺伝子に父親と母親のどちらの由来の遺伝子であるかが記憶される現象を「ゲノム刷り込み」といいます。これまで井上梓上級研究員らは、卵形成過程においてゲノムを収納するヒストンタンパク質への化学修飾(ヒストン修飾[2])が刷り込まれることで、受精後の初期胚と胎盤において刷り込み遺伝子の発現が制御されることを明らかにしていました。
今回、共同研究グループは、ゲノム刷り込みが破綻した際に起こる胎盤形成と胚発生異常の原因遺伝子を同定しました。さらに、これらの遺伝子の発現を正常化させることで、このような発生異常を防げることを示しました。
本研究は、科学雑誌『Genes & Development』オンライン版(2022年4月28日付:日本時間2022年4月29日)に掲載されました。
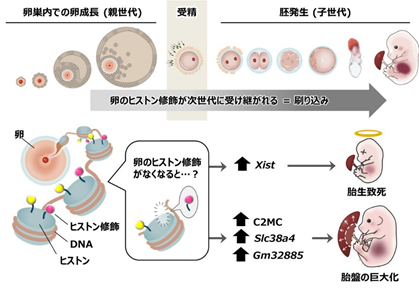
背景
細胞が分裂する際に、DNAだけでなくヒストン修飾も一緒に引き継がれることで、分裂前後の細胞は同様の性質を保ちます。しかし、卵と精子が受精し、次世代の胚へと細胞の性質が大きく変化するときには、ヒストン修飾はいったん消去されると考えられてきました。
ところが、井上梓上級研究員らの近年の研究により、卵のヒストンH3の27番目のリジン(K)残基のトリメチル化修飾(H3K27me3)は、受精後にも維持され、次世代の胚のゲノム機能を制御することが分かってきました注1,2)。H3K27me3は遺伝子発現を抑制する機能があり、これが受精後に母方染色体にのみ維持されることで、父方染色体だけから遺伝子発現が起こります。このような片親性の遺伝子発現制御機構は「ゲノム刷り込み」と呼ばれ、ヒストン修飾によるゲノム刷り込みは「非典型刷り込み[3]」といいます。
井上梓上級研究員らは、非典型刷り込みの機能を調べるために、H3K27me3の修飾酵素であるEedを欠損した卵を作製しました。すると、このEed欠損卵を受精させて得られる胚(Eed母性欠損胚)では、非典型刷り込みが破綻し、着床後の発生遅延、過半数の胚の胎生致死、および生存個体における胎盤の巨大化(過形成)などが生じることが明らかとなりました注2,3)。しかし、このような発生異常がどの遺伝子の刷り込み破綻が原因で起こるのかは分かっていませんでした。
注1)Inoue A, Jiang L, Lu F, Suzuki T, Zhang Y. (2017) Maternal H3K27me3 controls DNA methylation-independent imprinting. Nature .2017; 547(7664), 419-24.
注2)2021年4月6日理化学研究所プレスリリース「卵の記憶は胎盤へ」
注3)Inoue A, Chen Z, Yin Q, Zhang Y. (2018) Maternal Eed knockout causes loss of H3K27me3 imprinting and random X inactivation in the extraembryonic cells. Genes Dev .2018; 32(23-24), 1525-36.
研究手法と成果
この疑問に答えるため、共同研究グループは妊娠末期まで維持される9個の非典型刷り込み遺伝子に着目しました。これらの刷り込み遺伝子は、本来なら父方染色体からだけ発現しますが、Eed母性欠損胚においては父母両方の染色体から発現(両親性発現)します(図1上段右)。そこで、発生異常の原因が非典型刷り込み遺伝子の両親性発現にあるのかを検証するために、9個それぞれの非典型刷り込み遺伝子について、2対ある遺伝子の片方を欠損(ヘテロ欠損)させることで、Eed 母性欠損胚において当該刷り込み遺伝子の発現を正常化させる回復実験を行いました(図1下段)。
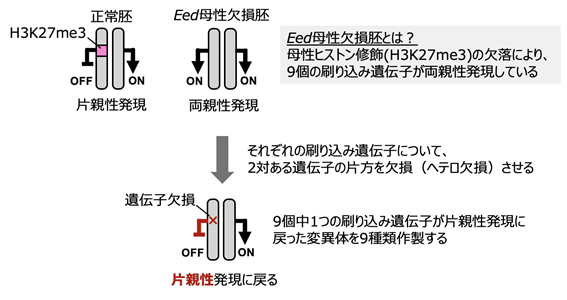
哺乳類の性染色体は雄がXY、雌がXXです。雌は機能するX染色体を雄と同じ1本にするために、胚発生時期に2本あるX染色体の1本を不活性化します。この「X染色体の不活性化」にはXist遺伝子[4]が必須です。井上梓上級研究員らは以前に、Eed母性欠損胚ではXist遺伝子の刷り込みが破綻し、父母両方のX染色体からXist遺伝子が発現してしまう結果、着床前発生過程において一過的に父母両方のX染色体が不活性化されることを見いだしていました注3)。
そこで今回、共同研究グループは、Xist遺伝子をヘテロ欠損させたマウスのEed/Xist母性欠損胚を作製し、Xist遺伝子の発現を片親性に戻しました。この胚の発生を詳細に調べたところ、Eed母性欠損胚で見られた着床後の発生遅延は改善し、さらに産仔までの生存率も改善しました(図2)。一方で、胎盤の過形成はXist遺伝子の発現正常化では全く改善されませんでした。このことから、Xist遺伝子の両親性発現がEed母性欠損胚の胎生致死の主な原因である一方で、胎盤過形成は他の遺伝子が原因であることが示されました。
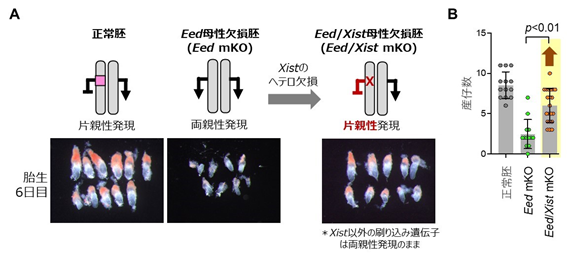
- 胎生6日のマウス胚の写真。Eed母性欠損胚では非典型刷り込み遺伝子が両親性発現し、発生遅延を示すが、Xist遺伝子だけをヘテロ欠損させて片親性発現に戻したEed/Xist母性欠損胚では発生が改善する。
- 産仔数。Eed母性欠損体は平均2~3匹しか出生しないが、Eed/Xist母性欠損体は平均6匹程度出生する。
続いて、胎盤過形成の原因遺伝子を同定するために、Eed/Xist母性欠損胚を用いて、残り8個の非典型刷り込み遺伝子それぞれをヘテロ欠損させ、各遺伝子の発現を正常化し、胎盤過形成が改善するかを調べました。その結果、Chromosome 2-miRNA cluster(C2MC)のヘテロ欠損により、胎盤を正常化できることが分かりました(図3)。C2MCは、胎盤で高発現するげっ歯類最大のマイクロRNAクラスター[5]です。また、胎盤の細胞におけるアミノ酸輸送に関与する遺伝子であるsolute carrier 38 member 4(Slc38a4)、または、機能未知遺伝子のGm32885のヘテロ欠損でも胎盤過形成の改善が認められました。一方で、その他の5個の刷り込み遺伝子のヘテロ欠損では、胎盤は改善しませんでした。このことから、C2MC、Slc38a4、Gm32885の両親性発現が胎盤過形成に寄与することが示されました。これらの遺伝子の両親性発現がどのように胎盤過形成を引き起こすのか、今後の研究が待たれます。
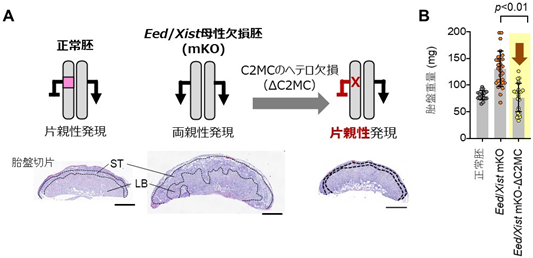
- 胎盤のHE染色切片像。Eed/Xist 母性欠損胚で著しかった胎盤過形成は、C2MCのヘテロ欠損胚で回復する。STは海綿栄養芽層、LBは迷路層を示す。スケールバーは1mm。
- 胎盤重量。C2MCのヘテロ欠損胚の胎盤は正常胚の胎盤と同程度になる。
今後の期待
卵や精子といった配偶子から次世代の胚へと伝わるヒストン修飾は、その異常が世代を超えて影響を及ぼす可能性があるため、広く注目されています。今回、卵におけるヒストン修飾の欠落により次世代の発生に異常を引き起こす遺伝子を複数同定することができました。この成果は、受精卵にゲノム変異がなくても、特定の遺伝子におけるヒストン修飾が変化すれば発生異常が起こり得ることを初めて証明したものであり、不妊症機序の解明につながると期待できます。
今後は、これらの遺伝子のヒストン修飾が卵形成過程でどのように確立され、受精後にどのように維持されるか、そしてこの確立・維持過程に親世代の環境がどのように影響するかなど、さらなる研究が待たれます。
論文情報
- タイトル
- Noncanonical imprinting sustains embryonic development and restrains placental overgrowth
- 著者名
- Shogo Matoba, Chisayo Kozuka, Kento Miura, Kimiko Inoue, Mami Kumon, Ryoya Hayashi, Tatsuya Ohhata, Atsuo Ogura, and Azusa Inoue
- 雑誌
- Genes & Development
- URL
- http://genesdev.cshlp.org/content/36/7-8/483.short
補足説明
- [1]刷り込み遺伝子
- 細胞には、自身の膨大なゲノム情報から必要な情報だけを取り出すためのゲノムの取扱説明書のような機構が備わっており、これをエピジェネティック機構という。エピジェネティック機構の分子実体は、DNAメチル化などのDNA自体への化学修飾と、DNAを収納するタンパク質であるヒストンへの化学修飾が主である。これらの化学修飾(エピジェネティック修飾)がゲノム内の適切な場所に配置することで、必要に応じた遺伝子を発現させることができる。卵と精子では、互いに異なるゲノム領域にエピジェネティック修飾が刻まれており、この一部が受精後も受け継がれることで、父親由来の染色体と母親由来の染色体のどちらか一方のみが機能を発揮する。このような遺伝子発現の制御機構をゲノム刷り込みという。刷り込み遺伝子は、ゲノム刷り込みを受ける遺伝子のこと。
- [2]ヒストン修飾
- 長い紐のようなDNAは、小さなビーズのようなヒストンタンパク質に巻き付くようにして核内に収納されている。ヒストンタンパク質のアミノ酸残基にはさまざまな化学修飾が付加され、これをヒストン修飾という。ヒストン修飾が付加されることで、紐(DNA)のビーズ(ヒストン)への巻きつき方が変化する。H3K27me3はヒストンH3の27番目のリジン残基(K)に三つのメチル基(トリメチル化)が付加したもので、代表的な抑制性ヒストン修飾の一つである。このような抑制性ヒストン修飾が付加されると、紐がビーズに強く巻きついたり、ビーズ同士がくっつき合って紐が外れにくくなったりする。
- [3]非典型刷り込み
- 刷り込みには、DNAメチル化依存的な「典型刷り込み」と、H3K27me3依存的な「非典型刷り込み」の2種類の機構がある。これらは、それぞれ異なる遺伝子群の発現を制御する。非典型刷り込み機構では、卵のH3K27me3が受精後も母方染色体(卵由来の染色体)だけに維持されて、遺伝子発現を抑制する。その結果、H3K27me3を持たない父方染色体(精子由来の染色体)からのみ遺伝子発現が許容されて、刷り込み発現が起こる。非典型刷り込みは、着床後には胎盤や卵黄嚢などの胚体外組織で維持される。
- [4]Xist遺伝子
- 雌は2本のX染色体を持つため、1本が不活性化される(X染色体不活性化)。X染色体不活性化を駆動する遺伝子がXistである。Xist遺伝子はX染色体上に存在し、長鎖非コードRNAをコードする。Xist RNAはX染色体上に抑制複合体を呼び込むことで、X染色体を不活性化させる。マウスの着床前胚においては、母性X染色体に存在するXist遺伝子は非典型刷り込みを受け、発現しない仕組みになっている。そのため、父性X染色体でのみXist遺伝子が発現し、不活性化される(刷り込み型X染色体不活性化という)。Xistはinactive X-specific transcriptsの略。
- [5]マイクロRNAクラスター
- マイクロRNAとは、メッセンジャーRNAからタンパク質への翻訳を抑制する機能を持つ小分子RNA。マイクロRNAをコードする遺伝子が複数存在する遺伝子座をマイクロRNAクラスターという。
共同研究グループ
- 理化学研究所
- 生命医科学研究センター
- 融合領域リーダー育成プログラム
- 上級研究員 井上 梓(イノウエ・アズサ)
- テクニカルスタッフⅡ 公文 麻美(クモン・マミ)
- 研修生 林 凌也(ハヤシ・リョウヤ)
- 免疫器官形成研究チーム
- 基礎科学特別研究員 小塚 智沙代 (コヅカ・チサヨ)
- バイオリソース研究センター
- 遺伝工学基盤技術室
- 室長 小倉 淳郎 (オグラ・アツオ)(開拓研究本部 小倉発生遺伝工学研究室 主任研究員)
- 専任研究員 的場 章悟(マトバ・ショウゴ)
- 専任研究員 井上 貴美子(イノウエ・キミコ)
- 広島大学 原爆放射線医科学研究所
- 助教 三浦 健人(ミウラ・ケント)
- 浜松医科大学 医学部
- 助教 大畑 樹也(オオハタ・タツヤ)
研究支援
本研究は、文部科学省科学研究費補助金新学術領域研究(研究領域提案型)「全能性プログラム:デコーディングからデザインへ(領域代表者:小倉淳郎、研究代表者:井上梓)」、日本学術振興会(JSPS)卓越研究員事業「Dissecting the molecular basis of oocyte-mediated transgenerational inheritance(研究代表者:井上梓)」、同科学研究費補助金基盤研究(B)「母性ヒストンによるゲノムインプリンティングの生理的意義の解明(研究代表者:井上梓)」「胎盤アミノ酸輸送系の破綻が引き起こす胎児代謝プログラム異常の解明(研究代表者:的場章悟)」、同若手研究「胎盤を介した肥満体質の遺伝機構の解明(研究代表者:小塚智沙代)」、同特別研究員奨励費「ヒストン修飾による母性エピゲノム遺伝機構の解明(研究代表者:林凌也)」、日本応用酵素協会若手研究助成事業「エピゲノムを介した肥満・糖尿病遺伝機構の解明と応用(研究代表者:小塚智沙代)」、日本医療研究開発機構(AMED)革新的先端研究開発支援事業PRIME「代謝疾患の母子間エピゲノム遺伝機構の解明(研究代表者:井上梓)」「経世代ヒストン修飾を介した疾患素因の形成機構(研究代表者:井上梓)」、上原財団助成金「胎盤を介した肥満体質の遺伝機構の解明(研究代表者:井上梓)」、理研横断エピゲノム操作プロジェクト(研究代表者:井上梓、小倉淳郎)、RIKEN Pioneering Projects「Genome building from TADs(研究分担者: 井上梓、小倉淳郎)」による支援を受けて行われました。
発表者・機関窓口
発表者
理化学研究所
生命医科学研究センター 融合領域リーダー育成プログラム
上級研究員 井上 梓(イノウエ・アズサ)
バイオリソース研究センター 遺伝工学基盤技術室
専任研究員 的場 章悟(マトバ・ショウゴ)
機関窓口
*今般の新型コロナウイルス感染症対策として、理化学研究所では在宅勤務を実施しておりますので、メールにてお問い合わせ願います。
理化学研究所 広報室 報道担当
E-mail:ex-press[at]riken.jp
AMED事業に関すること
日本医療研究開発機構
シーズ開発・研究基盤事業部 革新的先端研究開発課
TEL:03-6870-2224 FAX:03-6870-2246
E-mail:kenkyuk-ask[at]amed.go.jp
※上記の[at]は@に置き換えてください。
関連リンク
掲載日 令和4年4月28日
最終更新日 令和4年4月28日


