プレスリリース 世界初!神経回路で遠隔部位に炎症を生む分子機構を発見―関節リウマチなどの炎症性疾患の治療への応用に期待―
プレスリリース
北海道大学
自然科学研究機構生理学研究所
日本医療研究開発機構
ポイント
- 関節内の炎症を、特定の神経回路を介して逆側の関節内に伝播させる分子機構を発見。
- その分子機構は炎症で生じるATPにより活性化し、かつ逆側関節での ATP産生から炎症を誘導。
- 本神経回路、ATPの人為的制御による関節リウマチ、間質性肺炎、乾癬などの治療への応用に期待。
概要
北海道大学遺伝子病制御研究所、量子科学技術研究開発機構量子生命科学研究所、自然科学研究機構生理学研究所の村上正晃教授らの研究グループは、複数の関節リウマチモデルを用いて、炎症性疾患で遠隔部位に左右対称な炎症病変を生じさせる分子機構を明らかにし、これを「遠隔炎症ゲートウェイ反射*1」と定義しました。
関節リウマチ、間質性肺炎、乾癬などの炎症性疾患では、遠隔部位に左右対称な炎症病変が形成され、神経系の関連が示唆されていましたが、その実態は長らく全く不明でした。研究グループは、新規のゲートウェイ反射が形成に関与していると考え、関節リウマチモデルマウスを用いて検証し、新規の分子機構である「遠隔炎症ゲートウェイ反射」を発見しました。
遠隔炎症ゲートウェイ反射では、関節リウマチモデルマウスの片側の足関節の炎症で生じるATPにより、まず感覚神経、続いて脊髄のプロエンケファリン陽性介在神経の順で活性化し、その後、それに伴って反対側の足関節に分布する感覚神経が活性化しました。その結果、活性化した感覚神経から逆行性にATPが放出され、反対側の血管内皮細胞、線維芽細胞などでIL-6アンプ*2が活性化されることで炎症が誘導されました。すなわち、遠隔炎症ゲートウェイ反射では、ATPが神経伝達物質かつ炎症増悪因子として作用することがわかりました。これらの結果から、遠隔炎症ゲートウェイ反射の神経回路とATPは、関節リウマチ、間質性肺炎、乾癬など遠隔炎症を引き起こす炎症性疾患の治療標的となることが期待されます。
なお、本研究成果は、日本時間2022年5月17日(火)午後11時公開のJournal of Experimental Medicine誌にオンライン公開されました。
背景
関節リウマチ、間質性肺炎、乾癬などの炎症性疾患で遠隔部位に多発性に生じる炎症病変の形成には、神経系の関連が示唆されていましたが、その詳細な分子機構は解明されていませんでした。研究グループはこれまでに、重力、痛み、電気刺激、ストレス、光などの環境刺激・人為的刺激が、特異的な神経回路を活性化し、特定の血管部位に炎症性疾患を誘導・制御する「ゲートウェイ反射」と、炎症の引き金を血管内皮細胞に誘導する「IL-6アンプ」を発見し、報告してきました(北海道大学村上正晃研究室ホームページ:下記URL参照)。本研究では、新規のゲートウェイ反射が遠隔部位に多発性に生じる炎症病変の形成に関与するのではないかという仮説を立て、複数の関節リウマチモデルマウスを用いて検証し、新規の分子機構である「遠隔炎症ゲートウェイ反射」を発見しました。
研究手法
本研究では2つの関節リウマチモデルマウスを用いています。はじめに、炎症性サイトカインであるIL-6依存性の関節リウマチモデルマウスである、F759マウスを用いたサイトカイン誘導関節炎を誘導しました。F759マウスは、IL-6受容体の信号伝達分子であるgp130に変異があり、IL-6信号のネガティブフィードバック経路であるSCOS3が機能せずにIL-6信号でSTAT3*3シグナルが過剰となるマウスです。このマウスの足関節に炎症性サイトカインであるIL-6とIL-17Aを投与すると、2週間以内に関節炎が誘導されます。F759マウスの片側または両側足関節にサイトカインを接種して関節内の炎症を誘導し、特定の感覚神経回路や脊髄介在神経回路の遮断が左右足関節の炎症、左右感覚神経(後根神経節神経細胞)の活性化状態、脊髄介在神経の活性化状態にどう影響するかを評価しました。
また、本神経回路に関係する神経伝達物質を同定し、その受容体を阻害したときの左右の足関節での炎症、左右感覚神経(後根神経節神経細胞)の活性化状態、脊髄介在神経の活性化状態を評価しました。さらに、同様の実験を、より一般的な関節リウマチモデルマウスであるコラーゲン誘導関節炎モデルでも実施しました。
研究成果
F759マウスの足関節にサイトカインを投与すると、血管内皮細胞や滑膜線維芽細胞などの非免疫細胞でIL-6アンプが活性化し、ATPが局所的に過剰産生されました。ATPは、ATP受容体P2RX7を介して血管内皮細胞や滑膜線維芽細胞などでさらにIL-6アンプを活性化させると同時に、足関節に分布する感覚神経回路を活性化させ、その活性化した神経回路は、脊髄に接続していました(図)。
具体的には、第5腰髄のプロエンケファリン陽性介在神経細胞が活性化し、さらに下部胸髄のプロエンケファリン陽性介在神経細胞も活性化しました。続いて、この介在神経回路の活性化は、反対側の感覚神経を活性化させ、最終的に、反対側の足関節内で神経終末から逆行性にATPが放出され、血管内皮細胞や滑膜線維芽細胞でIL-6アンプの活性化が誘導されて、炎症が遠隔臓器である反対側の足関節に飛び火しました(図)。この遠隔炎症は、足関節へのP2RX7阻害剤投与、感覚神経の切断、下部胸髄(T9-T13)の正中での切断により阻害され、左右足関節での関節炎が改善しました。さらに、コラーゲン誘導性関節炎マウスでも同様の現象が認められました。
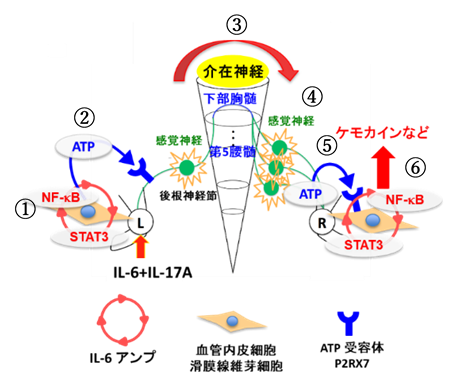
これらの結果から、遠隔炎症ゲートウェイ反射は、様々な遠隔炎症を引き起こす炎症性疾患に共通した分子機構であるものと、研究グループは結論付けました。
今後への期待
本研究の成果により、遠隔炎症の誘導が、特定の神経回路と関連神経伝達物質であるATPを介する信号伝達系の遮断により人為的に抑制できることが示されました。そのため、遠隔炎症によって病態を悪化させる関節リウマチ、間質性肺炎、乾癬などの炎症性疾患が、今回同定した神経回路と類似の神経回路やATPの阻害で治療可能になることが期待できます。
今後、さらに詳細に遠隔炎症ゲートウェイ反射の神経回路を解析し、その機能マーカー分子を同定することにより、人為的な神経回路の制御(ニューロモジュレーション法)による炎症性疾患の新たな治療法開発への応用の可能性も期待されます。
謝辞
本研究は、日本医療研究開発機構(AMED)「ムーンショット型開発事業」(22zf0127004h002)と文部科学省「光・量子飛躍フラッグシッププログラム(Q-LEAP)」(JPMXS0120330644)の研究費を用いて実施されました。
関連する研究成果
- 北海道大学プレスリリース 「Chronic stress induces fatal organ dysfunctions via a neural circuit(慢性ストレスは神経回路を介して致死性の臓器不全を誘導する)」
発表日:2017年8月21日 - 北海道大学プレスリリース 「HU Research on Gravity and Inflammation Response Selected for JAXA Feasibility Study(重力と炎症反応に関するHUリサーチがJAXAフィジビリティスタディに採択)
発表日:2016年2月1日 - 北海道大学プレスリリース「Neural Signal Due to Pain Induction Develops Relapse of a Multiple Sclerosis Model!(痛みにより誘導される神経回路により、多発性硬化症モデルの病気が再発する)」
発表日:2015年 6月22日
論文情報
- 論文名
- ATP spreads inflammation to other limbs through crosstalk between sensory neurons and interneurons(ATPは感覚ニューロンと介在ニューロンの間のクロストークを介して他の手足に炎症を広げる)
- 著者名
- 長谷部理絵1,2、村上薫1、原田誠也4、Nada Halaka1、中川浩4、河野史倫5、大平充宣5、川本忠文6、Fiona E. Yull7、Timothy S. Blackwell7、小林純子8、岩永俊彦8、渡辺雅彦8、渡邊信博9、堀田晴美9、山下俊英4、上村大輔1、田中勇希1,3、村上正晃1,2,3
(1北海道大学遺伝子病制御研究所分子神経免疫学分野、2自然科学研究機構生理学研究所分子神経免疫研究部門、3 量子科学技術研究開発機構量子生命科学研究所量子免疫学研究チーム、4大阪大学免疫学フロンティアセンター、5大阪大学大学院生命機能研究科、6鶴見大学歯学部、7 ヴァンダービルト大学、8北海道大学大学院医学研究院、9東京都長寿医療センター) - 雑誌名
- Journal of Experimental Medicine(医学の専門誌)
- DOI
- 10.1084/jem.20212019
- 公表日
- 日本時間2022年5月17日(火)午後11時(米国東部夏時間2022年5月17日(火)午前10時)(オンライン公開)
用語解説
- *1 ゲートウェイ反射
- 特定の環境刺激・人為的刺激により、特異的神経回路が活性化し、神経伝達物質であるノルアドレナリンが特定の⾎管部位に放出されることで、通常は免疫細胞が侵⼊できない中枢神経系(脳、脊髄)の⾎管に、血液中の免疫細胞の侵⼊⼝(血管ゲート)が形成される現象のこと。2012年に村上教授らの研究グループが世界で初めて発⾒した現象であり、これまでに重力、筋⾁への微弱な電気刺激(Cell 2012)、痛み刺激(eLife 2015)、慢性ストレス(eLife2017)、光(Sci Rep 2019)によるゲートウェイ反射を報告している。
- *2 IL-6アンプ
- ⾎管内⽪細胞、線維芽細胞、軟骨細胞などの⾮免疫細胞において、転写因⼦*4NF-κBとSTAT3が同時に活性化することで、NF-κBが過剰に活性化し、免疫細胞を引き寄せるケモカイン*5を含むNF-κB標的遺伝⼦群が過剰発現し、局所炎症を誘導する機構。
- *3 STAT3
- NF-κBとともに炎症関連遺伝子の発現に関与する主要な転写因⼦。炎症時には主にIL-6の下流で活性化する。
- *4 転写因⼦
- 染色体DNAに特異的に結合し、mRNAへの転写を誘導するタンパク質。
- *5 ケモカイン
- 免疫細胞を引き寄せる液性タンパク質の⼀種。現在50種類近くが知られている。
お問い合わせ先
北海道大学遺伝子病制御研究所 教授 村上正晃(むらかみまさあき)
TEL:011-706-5121 FAX:011-706-7542 メール:murakami”AT”igm.hokudai.ac.jp
Murakami Lab
配信元
北海道大学社会共創部広報課(〒060-0808 札幌市北区北8条西5丁目)
TEL:011-706-2610 FAX:011-706-2092 メール:jp-press”AT”general.hokudai.ac.jp
自然科学研究機構 生理学研究所 研究力強化戦略室
TEL:0564-55-7722 FAX:0564-55-7721 メール:pub-adm”AT”nips.ac.jp
AMED事業に関すること
日本医療研究開発機構 研究開発統括推進室 基金事業課(ムーンショット事務局)
メール:moonshot”AT”amed.go.jp
※メールは上記アドレス“AT”の部分を@に変えてください。
関連リンク
掲載日 令和4年5月18日
最終更新日 令和4年5月18日


