プレスリリース CRISPR-Cas9を用いたHLAゲノム編集iPS細胞の作製方法と臨床応用に向けた詳細評価
プレスリリース
公益財団法人京都大学iPS細胞研究財団(CiRA_F)
国立研究開発法人日本医療研究開発機構(AMED)
ポイント
- 免疫拒絶リスクを低減するため、CRISPR-Cas9(注1)を用いてHLA-A、HLA-B、CIITAの3つの遺伝子を同時にゲノム編集して、短期間でiPS細胞を作製する方法、及びその品質評価プロセスを確立しました。
- 同時多重ゲノム編集したiPS細胞を解析した結果、遺伝子の大規模欠損、逆位、染色体転座(注2)など、多くの遺伝子異常が認められましたが、適切な品質試験を行うことで遺伝子異常の無い細胞を選択することが可能でした。
- 当財団では本研究成果をもとに、臨床用HLAゲノム編集iPS細胞の製造を進めています。
要旨
人工多能性幹細胞(iPS細胞)を用いた再生医療の可能性を広げるためには、ヒト白血球抗原(HLA)(注3)遺伝子を正確かつ効率的にゲノム編集し、HLA型のミスマッチに起因する免疫拒絶反応を最小限に抑えた低免疫原性iPS細胞の作製が望まれています。しかし、ヒトiPS細胞における複数のHLA遺伝子の臨床応用可能なゲノム編集は、未だ達成されていません。本研究では、HLAホモ接合体iPS細胞(注4)において、3つの遺伝子座(HLA-A、HLA-B、CIITA遺伝子)を同時編集するGMP(注5)対応のCRISPR-Cas9ゲノム編集のプロトコールを開発しました。HLAホモ接合体iPS細胞を用いる利点は、HLA-A、HLA-B両遺伝子座に対して一つのgRNAだけで各遺伝子座の両アリルのゲノム編集を誘導できることにあります。RNAシークエンスおよびフローサイトメトリー解析により、標的HLAタンパク質の発現消失を確認し、心筋細胞への系統特異的な分化能が保持されることが確認されました。また、ゲノム編集したiPS細胞の三胚葉への分化により、多能性を維持していることを確認しました。さらに、全ゲノムシークエンス(WGS)、核型解析、オプティカルゲノムマッピング解析により、一部のゲノム編集細胞では複数のゲノム編集標的部位が関わった遺伝子コピー数変異(CNV)(注6)、染色体転座、複雑なゲノム構造変異が観察され、ゲノム編集細胞の安全性と品質を確保するため、多角的な解析を行うことの重要性が示されました。結果として、これらの品質試験を行うことにより、目的外の遺伝子変異の無いiPS細胞を選択することができました。今回報告した製造及び品質評価プロトコールは、臨床用iPS細胞をゲノム編集するための基盤技術となります。
本研究成果は2022年6月11日にMolecular Therapy - Methods & Clinical Development誌のオンライン版に掲載されました。
研究の背景
近年、CRISPR-Cas9ゲノム編集技術を用いて、HLA-Cを保持したまま、HLA-A、HLA-BおよびCIITA遺伝子を選択的にノックアウトし、免疫拒絶反応を抑制する新しい戦略が開発されました(Xu and Wang et al.,Cell Stem Cell, 2019)。このようなHLAゲノム編集iPS細胞は、HLA-A、HLA-B、およびHLAクラスⅡが欠失していることで、キラーT細胞(注7)およびNK細胞(注8)の両方の攻撃を回避できることが示されています。複数の遺伝子をノックアウトするために段階的なゲノム編集を実施した場合、培養期間は長期間に及びます。一方、同時に複数の遺伝子を同時にノックアウトする多重ゲノム編集では培養期間を大幅に削減出来るため、細胞培養に伴うゲノム変異等のリスクを最小限に抑えられる点で有利ですが、染色体間の大規模なゲノム構造異常の可能性があります。さらに、HLA遺伝子のゲノム編集では、通常考慮すべきオフターゲット変異(注9)リスクに加えて、HLA遺伝子のDNA配列が互いに類似していることから、他の遺伝子座を標的とする場合よりもさらに変異誘発や染色体再配列のリスクが高くなる可能性があります。このため、品質評価方法については、これまで以上に留意する必要がありますが、臨床用製造や品質評価方法におけるリスク評価は十分に解析されていませんでした。
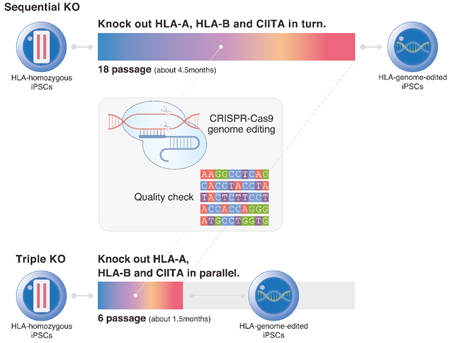
研究結果
HLA-A、HLA-B、CIITAの3つの遺伝子を同時にゲノム編集したiPS細胞を製造する手法を確立しました(図1)。Cas9タンパク質と化学合成した2種のgRNA(HLA-AとHLA-Bは共通のgRNAで編集できるよう設計したため1種のgRNAで2つの遺伝子の編集が可能)の複合体をHLAホモ接合体iPS細胞(Ff-I14s04株)にエレクトロポレーションで導入。その後、シングルセルクローニング(注10)を行い、ゲノム解析と分化能評価を含む細胞機能アッセイを実施しました。その結果、HLA遺伝子座のゲノム編集は、WGS、核型解析、オプティカルゲノムマッピング分析によって評価した複数のクローンにおいて、複数のゲノム編集標的部位が関わったCNV、染色体転座、複雑なゲノム構造変異を引き起こしていたことが判明(図2)しました。しかし、本研究グループが実施した多角的な品質試験で、これらの変異を十分に追跡・解析することができ、目的としたゲノム編集以外の変異リスクを抑えた細胞を選択することが可能となりました。
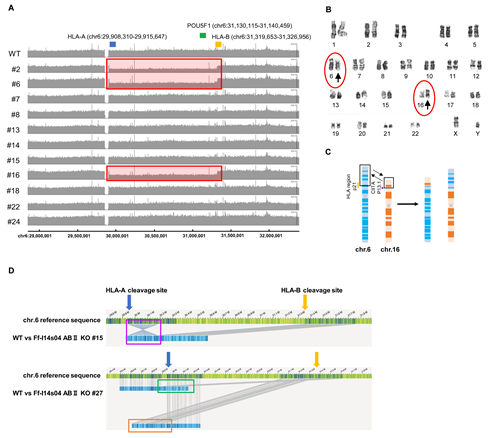
- 6番染色体上のHLAクラスI遺伝子クラスターにおける全ゲノムシークエンス結果に基づく遺伝子コピー数の解析結果を示す。HLA-A(青)、HLA-B(オレンジ)、POU5F1(緑)の位置は図に示したとおりである。解析した11個のiPS細胞クローン中、3個のクローンはHLA-A遺伝子とHLA-B遺伝子の間でコピー数が減少(赤枠で示した)し、この領域で大規模な遺伝子欠損が起こっていることが示された。
- ゲノム編集されたiPS細胞のGバンディングによる核型解析を示す。 6番染色体と16番染色体で転座が認められた(赤丸で囲んだ矢印部)。
- 6番染色体と16番染色体間の転座モデルを示す。解析した30個のiPS細胞クローン中7個のクローンで転座が認められた。
- オプティカルゲノムマッピングでの解析結果を示す。複雑なゲノム構造変異が観察された。青いバーは変異した染色体領域を示す。
今後の展開・まとめ
今回の研究により、臨床用iPS細胞におけるCRISPR-Cas9を用いた同時多重HLAゲノム編集の課題と解決策について、基盤技術となる成果を得ることができました。これは、ゲノム編集した低免疫原性iPS細胞を臨床応用につなげるために、ゲノム解析を含む、多角的な品質評価試験が重要であることを示しています。本成果に基づいて、臨床用のHLAゲノム編集iPS細胞を早期に提供できるよう、京都大学iPS細胞研究財団(CiRA_F)細胞調製施設にて製造を進めています。
論文名と著者
- 論文名
- Generation of hypoimmunogenic induced pluripotent stem cells by CRISPR-Cas9 system and detailed evaluation for clinical application.
- doi
- 10.1016/j.omtm.2022.05.010
- ジャーナル名
- Molecular Therapy - Methods & Clinical Development
- 著者
- Yuko Kitano1, Sayaka Nishimura1, Tomoaki M Kato1, Anna Ueda1, Kaho Takigawa1, Masafumi Umekage1, Masaki Nomura1, Ayane Kawakami1, Haruna Ogawa1, Huaigeng Xu2,3, Akitsu Hotta2, Naoko Takasu1, Masayoshi Tsukahara1*
*責任著者 - 著者の所属機関
-
- 京都大学iPS細胞研究財団(CiRA_F)
- 京都大学iPS細胞研究所(CiRA)
- Eli and Edythe Broad Center of Regeneration Medicine and Stem Cell Research, University of California San Francisco
本研究への支援
本研究は、以下機関より支援を受けて実施されました。
- 日本医療研究開発機構(AMED)
再生医療実現拠点ネットワークプログラムiPS細胞研究中核拠点(JP20bm0104001h0108)
用語説明
- (注1)CRISPR-Cas9
- 意図した場所のゲノムDNAを切断して、細胞のゲノム編集を行うことが可能な技術。発明者は2020年ノーベル化学賞を受賞。
- (注2)染色体転座
- 2つの異なる染色体の一部が入れ替わること。
- (注3)ヒト白血球抗原(HLA)
- 免疫に関わる白血球の血液型として発見されたが、ほぼ全ての細胞が持ち、自分と他人、異常な細胞を見分ける目印となっている。
- (注4)HLAホモ接合体iPS細胞
- 「父親と母親から同じHLA型を受け継いだ人」の細胞から作製したiPS細胞。現在、当財団では、日本人の約40%に対して免疫拒絶反応が起こりにくい「HLAホモiPS細胞ストック」を製造・保管・配布を行っている。
- (注5)GMP
- Good Manufacturing Practiceの略。「医薬品の製造管理及び品質管理の基準」と訳される。国によって定められた、医薬品を製造する上で必須の要件のこと。
- (注6)CNV
- Copy Number Variation(コピーナンバーバリアント)の略。遺伝子のコピー数が通常と異なっていること。
- (注7)キラーT細胞
- HLAクラスⅠを認識し、がん細胞やウイルスに感染した細胞などの異常な細胞や他人の細胞(HLAが異なる細胞)を攻撃する、免疫に関わる細胞。
- (注8)NK細胞
- キラーT細胞を類似の機能を有するが、より広範囲に異常な細胞を認識して攻撃する、免疫に関わる細胞。
- (注9)オフターゲット変異
- ゲノム編集において、標的遺伝子以外への部位へ意図しない変異が起きること。
- (注10)シングルセルクローニング
- 複数の細胞集団の中から、1つの細胞を取り出し、同一の遺伝子を持つクローンを作製すること。
お問い合わせ先
研究・報道に関すること
公益財団法人 京都大学iPS細胞研究財団
広報グループ
E-mail:contact*cira-foundation.or.jp
(お手数をおかけしますが、*を@に変えてください。)
AMED事業に関すること
国立研究開発法人 日本医療研究開発機構(AMED)
再生・細胞医療・遺伝子治療事業部 再生医療研究開発課
TEL:03-6870-2220
E-mail:saiseinw*amed.go.jp
(お手数をおかけしますが、*を@に変えてください。)
関連リンク
掲載日 令和4年6月13日
最終更新日 令和4年6月13日


