プレスリリース CAMSAP2タンパク質による中心体に依存しない微小管ネットワーク形成のしくみを解明―細胞の形を作る仕組みの一端を解明―
プレスリリース
神戸大学
理化学研究所
東北大学
科学技術振興機構
日本医療研究開発機構
神戸大学大学院医学研究科の仁田亮教授、今崎剛助教らの研究グループは、理化学研究所生命機能科学研究センターの竹市雅俊客員主管研究員(理研名誉研究員)、同放射光科学研究センター生物系ビームライン基盤グループ重松秀樹研究員(研究当時、現高輝度光科学研究センター構造生物学推進室研究員)、東北大学学際科学フロンティア研究所の丹羽伸介准教授らとの共同研究により、細胞の構築・極性形成※1に重要な役割を果たす微小管ネットワーク※2が、CAMSAP2タンパク質の相分離※3する性質を利用して形成されることを、クライオ電子顕微鏡※4や全反射照明蛍光顕微鏡※5を用いて明らかにしました。本研究成果は、心筋細胞、神経細胞、上皮細胞、線維芽細胞などの細胞を形づくる際に用いられる、細胞の根源的なしくみを説明するものです。この研究成果は、2022年6月28日に、国際学術雑誌「eLife」にオンライン掲載されました。
ポイント
- CAMSAP2は相分離する性質を利用して内部にチューブリン(微小管を作るタンパク質)を取り込んで濃縮し、短時間で数え切れないほどの微小管重合核を形成する。そこが微小管形成中心となり、放射状に微小管が伸長し、Cam2-aster※6を形成する。
- CAMSAP2から始まる微小管ネットワーク形成は、心筋細胞、神経細胞、上皮細胞、線維芽細胞など、中心体に依存しない微小管ネットワークが牽引する細胞極性形成・維持機構の理解に重要である。
研究の背景
微小管ネットワークは、細胞内で高度に組織化された細胞骨格であり、細胞形態の構築や極性制御に重要な役割を果たします。微小管ネットワーク形成の制御には、γ-tubulin ring complex(γ-TuRC)が唯一の微小管形成中心(MTOC) であると長い間考えられてきました。しかし近年、心筋細胞、神経細胞、上皮細胞、線維芽細胞などの極性の高い細胞において、γ-TuRCに依存しないネットワーク形成、すなわち非中心体性微小管ネットワークが報告され、その形成機構に注目が集まっていました。
CAMSAPs(calmodulin-regulated spectrin-associated proteins)は、哺乳類に3つのファミリー遺伝子を持ち、γ-TuRC同様に微小管の伸長開始端(=マイナス端)に結合するタンパク質ファミリーです。CAMSAPsの一つであるCAMSAP2は、ゼブラフィッシュの非対称性形成に重要であること、またCAMSAP3の欠損や機能障害は、微小管の整列を乱すことで上皮細胞の形態や機能に異常をきたすことが報告されています。CAMSAPは微小管伸長開始端に結合することや細胞の極性形成に関与することから、γ-TuRCに依存しないMTOC制御因子の候補として注目し、本研究を開始しました。
研究の内容
微小管は細胞骨格や細胞内物質輸送を担う超分子複合体で、チューブリンが連なった中空の管状構造をしています。試験管内では濃度20µM以上のチューブリンを37℃程度に温めれば、自然にチューブリンから微小管への伸長(以下重合と呼ぶ)が起こることが分かっています。一方、細胞内のチューブリン濃度は数 µMと低く、微小管重合核を作るタンパク質の助けを借りて微小管が作られます。微小管重合核を作るタンパク質には主に中心体に存在する γ-TuRC質複合体が知られていましたが、中心体以外(以下非中心体と呼ぶ)でどのように微小管ができるのかは分かっていませんでした。
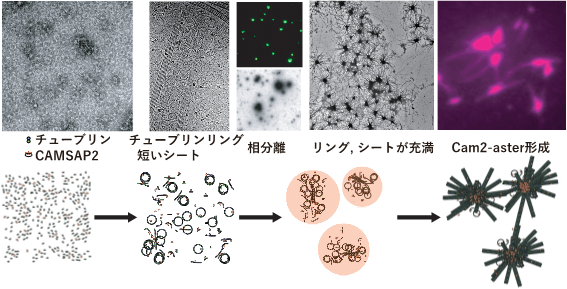
今回本研究グループは、γ-TuRCと同様に微小管に結合して末端を安定化させるCAMSAP2に注目して研究を始めました。試験管内でCAMSAP2とチューブリンを混ぜて実験を行ったところ、チューブリンのみだと微小管形成は 20µM 程度にならないと起こらないところ、CAMSAP2 を混ぜると微小管形成は 1-2 µM と細胞内より低い濃度でも起こることを発見しました。つぎに本研究グループはCAMSAP2の動態を蛍光顕微鏡で観察してみたところ、CAMSAP2が相分離を介して集まり油滴様になり、その油滴の中にチューブリンを選択的に取り込み、局所的に濃縮していることを発見しました。さらに全反射照明蛍光顕微鏡を使い、CAMSAP2とチューブリンを混合後37℃にした状態を経時的に観察したところ、CAMSAP2を取り込んだチューブリン油滴から放射状に微小管伸長が始まり、その後微小管ネットワーク様の構造を作ることが分かりました。この様子が中心体における星状体に非常によく似ていることから、本研究グループはこれをCam2-asterと命名しました。この様子を当研究室所有の電子顕微鏡やSPring-8、大阪大学超高圧電子顕微鏡センター所有のクライオ電子顕微鏡で詳細に観察したところ、CAMSAP2とチューブリンは相分離を介してチューブリンを取り込んだ後、非常に短い時間でCam2-asterを形成し、その過程でチューブリンが縦にカールしながら連なるリング様構造や、縦に連なったチューブリンが数本集まってシート様構造を作り微小管となる、といった中間状態の観察に成功しました。これらのことからCAMSAP2は相分離を利用してMTOCを作り、その中で中間体・微小管形成を促し、Cam2-asterを介した微小管ネットワーク形成を行う機構を提唱しました(図参照)。
今後の展開
CAMSAPが非中心体性微小管ネットワークの形成を誘導するという発見は、心筋細胞、神経細胞、上皮細胞、線維芽細胞など、微小管ネットワークが重要な役割を果たす細胞の極性形成の基本的なメカニズムを理解する上で、非常に重要です。例えば、心筋細胞特有の円筒形の形態形成・収縮に対する抵抗性の獲得に、非中心体性微小管ネットワークが重要な役割を果たしています。その重要性から本成果は神経科学、細胞生物学、発生生物学、構造生物学、循環器科学といった幅広い分野への波及が期待されます。また、非中心体性微小管ネットワークの異常は心不全、神経変性疾患、癌などの原因としても知られ、今回明らかとなった新規の微小管ネットワーク形成メカニズムが、その病因解明・新規治療法創出の第一歩になると考えています。さらに、微小管形成過程における多くの中間体の観察に成功していることからも、チューブリンから微小管への伸長過程の分子論的理解に大いに役立ちます。
用語解説
- ※1 細胞の極性
- 細胞の特徴をきめる形態、構造。極性形成には、細胞骨格分子であるアクチンや微小管が重要な役割を果たす。
- ※2 微小管ネットワーク
- 微小管が形成する細胞の骨組みとなるネットワーク構造で、細胞の形態形成や細胞内物質輸送のための道路としても機能しています。
- ※3 相分離
- 2つの液体が互いに混ざり合わず、2相に分離する現象を相分離と言います。近年の研究により、一部のタンパク質は水の中の油のように分離して、相分離することが分かってきました。水溶液中でタンパク質が相分離すると、油滴のように集まって化学反応の場を形成し、特定の機能を発揮します。
- ※4 クライオ電子顕微鏡
- 核酸やタンパク質などの生体試料を観察するために開発された電子顕微鏡で、クライオ電子顕微鏡の技術開発を行った3人の研究者は2017年度のノーベル化学賞を受賞しました。生体試料を含んだ溶液を薄く展開し、液体エタン(-183℃~-160℃)中で急速凍結して試料をごく薄い氷の層に閉じ込めた上、液体窒素温度(-196℃)で電子顕微鏡により観察します。試料を染色固定する方法に比べて、低温で電子線を照射するために試料の電子線による損傷が軽減されること、また試料を生理的な溶液条件で観察できること、などの利点があります。
- ※5 全反射照明蛍光顕微鏡
- トンネル効果によりしみ出すレバネッセント光を励起光源とした蛍光顕微鏡です。光学顕微鏡より高い分解能を備えるため、微小管や微小管結合タンパク質一分子の観察が可能です。
- ※6 Cam2-aster
- CAMSAP2はチューブリンを取り込んで微小管伸長を誘導しますが、その際、中心体に似た星状体構造を作ります。本研究グループは、その星状体構造をCam2-asterと命名しました。
謝辞
本研究は、文部科学省科研費学術変革領域研究A「クロススケール細胞内分子構造動態解析が解明する細胞骨格ネットワーク構築とその破綻(クロススケール新生物学)」(研究代表者:仁田亮)、内閣府ムーンショット型研究開発事業「臓器連関の包括的理解に基づく認知症関連疾患の克服に向けて」(研究代表者: 高橋良輔)、日本医療研究開発機構(AMED)革新的先端研究開発支援事業ユニットタイプ(AMED-CREST)「心筋メカノバイオロジー機構の解明による心不全治療法の開発(メカノバイオロジー機構の解明による革新的医療機器及び医療技術の創出)」(研究代表者:小室一成)、「革新的化合物探索・合成手法による新規抗菌アジュバントの創出 (感染症創薬に向けた研究基盤の構築と新規モダリティ等の技術基盤の創出)」(研究代表者:鈴木仁人)、科学技術振興機構(JST)創発的研究支援事業 「微小管を軸とした細胞極性形成機構の解明」(研究代表者:今崎剛)、文部科学省科研費、武田科学振興財団、持田記念医学薬学振興財団、上原生命科学財団等の支援を受けて行ったものです。
論文情報
- タイトル
- “CAMSAP2 organizes a γ-tubulin-independent microtubule nucleation centre”
- DOI
- 10.7554/eLife.77365
- 著者
- Tsuyoshi Imasaki1-3†, Satoshi Kikkawa1†, Shinsuke Niwa4*, Yumiko Saijo-Hamano1, Hideki Shigematsu5, Kazuhiro Aoyama6,7, Kaoru Mitsuoka7, Takahiro Shimizu1, Mari Aoki3, Ayako Sakamoto3, Yuri Tomabechi3, Naoki Sakai5, Mikako Shirouzu3, Shinya Taguchi1, Yosuke Yamagishi1, Tomiyoshi Setsu1, Yoshiaki Sakihama1, Eriko Nitta1, Masatoshi Takeichi8, Ryo Nitta1,3*
- 1Division of Structural Medicine and Anatomy, Department of Physiology and Cell Biology, Kobe University Graduate School of Medicine, Kobe, 650-0017, Japan
2JST, PRESTO, Saitama, 332-0012, Japan
3RIKEN Center for Biosystems Dynamics Research, Yokohama, 230-0045, Japan
4Frontier Research Institute for Interdisciplinary Sciences, Tohoku University, Sendai, 980-0845, Japan
5RIKEN SPring-8 Center, Hyogo, 679-5148, Japan
6Materials and Structural Analysis (ex FEI), Thermo Fisher Scientific, Tokyo, 140-0002, Japan
7Research Center for Ultra-High-Voltage Electron Microscopy, Osaka University, Osaka, 567-0047, Japan
8RIKEN Center for Biosystems Dynamics Research, Kobe, 650-0047, Japan
†These authors contributed equally to this work
*corresponding author - 掲載誌
- eLife
お問い合わせ先
研究について
神戸大学神戸大学大学院医学研究科 生理学細胞生物学講座 生体構造解剖学分野
教授 仁田 亮(にった りょう)
E-mail: ryonitta[at]med.kobe-u.ac.jp
理化学研究所 放射光科学研究センター 生物系ビームライン基盤グループ
研究員(研究当時)重松 秀樹(しげまつ ひでき)
(現 高輝度光科学研究センター 構造生物学推進室 研究員)
TEL:0791-58-2839 FAX:0791-58-2834
E-mail:shigematsu[at]spring8.or.jp
東北大学 学際科学フロンティア研究所 先端学際基幹研究部
准教授 丹羽 伸介(にわ しんすけ)
E-mail:shinsuke.niwa.c8[at]tohoku.ac.jp
報道について
神戸大学総務部広報課
TEL:078-803-5453
E-mail:ppr-kouhoushitsu[at]office.kobe-u.ac.jp
理化学研究所広報室報道担当
E-mail:ex-press[at]riken.jp
東北大学 学際科学フロンティア研究所 企画部
特任准教授 藤原 英明(ふじわら ひであき)
E-mail:hideaki[at]fris.tohoku.ac.jp
科学技術振興機構広報課
TEL:03-5214-8404
E-mail: jstkoho[at]jst.go.jp
JST事業について
科学技術振興機構 戦略研究推進部 創発的研究支援事業推進室
中神 雄一(なかがみ ゆういち)
TEL:03-5214-7276
E-mail: souhatsu-inquiry[at]jst.go.jp
AMED事業について
日本医療研究開発機構(AMED)革新的先端研究開発支援事業担当
Email:kenkyuk-ask[at]amed.go.jp
※上記の[at]は@に置き換えてください。
関連リンク
掲載日 令和4年6月28日
最終更新日 令和4年6月28日


