成果情報 非アルコール性脂肪性肝疾患の発症機構を解明:脂肪肝リスク遺伝子であるLPIAT1の機能低下が脂肪肝の発症を引き起こすメカニズムを解明
成果情報
東京大学
日本医療研究開発機構
発表者
田中 悠貴(東京大学大学院薬学系研究科 大学院生)
嶋中 雄太(東京大学大学院薬学系研究科 助教:研究当時)
河野 望 (東京大学大学院薬学系研究科 准教授)
新井 洋由(東京大学名誉教授)
発表のポイント
- リン脂質生合成酵素の一種であるLPIAT1の発現低下が非アルコール性脂肪性肝疾患(NAFLD)の発症と増悪を引き起こすことを明らかにしました。
- LPIAT1の発現低下がNAFLDの発症を引き起こす詳細なメカニズムを解明しました。
- LPIAT1の一塩基多型(SNP)は非アルコール性脂肪性肝疾患のリスクとなることが知られており、本研究はNAFLDの発症機構に基づいた治療薬の開発につながることが期待されます。
発表概要
近年、飲酒の習慣がないにも関わらず肝臓に中性脂質が蓄積する非アルコール性脂肪性肝疾患(Non-Alcoholic Fatty Liver Disease、NAFLD)(注1)の患者が急増しています。NAFLDは肝細胞に中性脂質が蓄積した単純な脂肪肝であるケースがほとんどですが、一部は重症化し、非アルコール性脂肪性肝炎を経て肝硬変や肝がんへと進行します。そのため脂肪肝の重症化を抑制することが大きな課題となっていますが、脂肪肝の発症機構や重症化のメカニズムの全貌は未だに解明されておらず、治療法も確立されていません。
今回、東京大学大学院薬学系研究科の新井 洋由 教授・河野 望 准教授のグループは、スウェーデンのヨーテボリ大学のStefano Romeo博士らのグループと共同で、生体膜リン脂質の生合成酵素の一種であるlysophosphatidylinositol acyltransferase 1(LPIAT1)(注2)の発現低下が脂肪肝の発症と増悪を引き起こすことを明らかにし、LPIAT1機能低下による脂肪肝発症の分子メカニズムを解明することに成功しました。最近、LPIAT1の一塩基多型(SNP)(注3)が脂肪肝の発症と増悪に関わることが多数報告され、ヨーロッパ人肥満患者の実に6割がこのSNPを有するとも報告されています。本研究の成果はNAFLDという疾患の理解に貢献するとともに、未だ治療法の確立されていないNAFLDに対する治療戦略の考案につながることが期待されます。
本研究は、AMEDの革新的先端研究開発支援事業(AMED-CREST)「疾患における代謝物の解析および代謝制御に基づく革新的医療基盤技術の創出」(研究開発総括:清水孝雄)における研究開発課題「生体膜リン脂質を基軸とした医療基盤技術の開発」(研究開発代表者:新井洋由)の一環でおこなわれました。
本研究の成果は、2020年4月6日に英国科学雑誌Gut誌に掲載されました。
発表内容
研究の背景
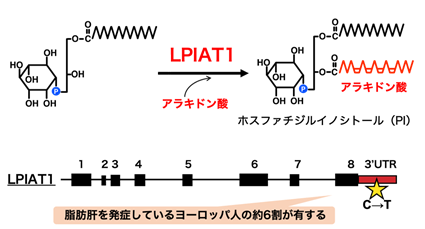
肝細胞に中性脂質が蓄積して肝障害を引き起こす病態を脂肪性肝疾患と呼びます。脂肪肝の主な原因として、過度の飲酒やB型・C型関連ウイルス感染が知られていますが、近年飲酒の習慣がないに関わらず発症する非アルコール性脂肪性肝疾患(Non-alcoholic Fatty Liver Disease: NAFLD)の患者が急増しており、日本だけでも1000万人以上の患者が存在すると推定されています。脂肪肝は重症化すると非アルコール性脂肪性肝炎を経て肝硬変や肝がんへと進行するため、脂肪肝の発症と重症化を抑制することが有効な治療戦略になります。しかし、脂肪肝の発症と重症化に関わる機構は未だ明らかでない部分が多く残されており、治療法も対症療法にとどまっています。近年、ゲノムワイド関連解析(Genome Wide Association Study:GWAS)(注4)により、遺伝的要因がNAFLDの発症と増悪に関わることが明らかになってきました。その中でも、LPIAT1(lysophosphatidylinositol acyltransferase 1)と呼ばれる酵素の一塩基多型(single nucleotide polymorphism:SNP)は、ヨーロッパの肥満患者の実に6割が有すると報告されており、世界的な注目を浴びています。しかしながら、LPIAT1は生体膜リン脂質の一種であるホスファチジルイノシトール(PI)(注5)にアラキドン酸を導入するリン脂質脂肪酸リモデリング酵素(注6)であり、なぜPIのリモデリング酵素がNAFLDと相関するのか全く明らかでありませんでした(図1)。
研究の成果
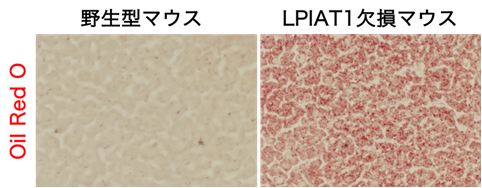
本研究ではLPIAT1のSNPとNAFLDの関連性を明らかにするために、肝細胞特異的にLPIAT1を欠損したマウスを作成しました。その結果、肝細胞特異的なLPIAT1欠損マウスの肝臓では通常飼育条件下で中性脂質が蓄積しており、脂肪肝を自然発症することが明らかとなりました(図2)。また高脂肪食を4ヶ月間与え人為的に脂肪肝を誘導した際に、肝臓において中性脂質の蓄積のみならず、炎症や線維化が亢進し、脂肪肝が重症化していることが明らかになりました。この結果から肝細胞におけるLPIAT1の発現低下が脂肪肝の発症と増悪を引き起こすことが明らかになりました。
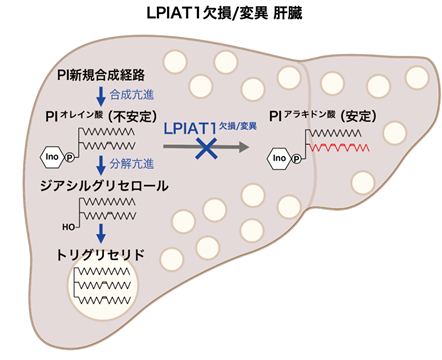
本研究ではさらにLPIAT1の発現低下が脂肪肝の発症と増悪を引き起こすメカニズムを詳細に解析しました。肝臓において合成された中性脂質は、一部はリポタンパク質として血中へと放出され、一部は肝臓中に蓄積された後にエネルギー源として分解されます。この中性脂質の合成、分泌、分解のいずれの異常も肝臓への中性脂質の蓄積を引き起こすことから、LPIAT1を欠失した肝細胞における中性脂質の動態を詳細に解析しました。その結果、LPIAT1を欠損した肝細胞では中性脂質の合成が過剰に亢進していることが明らかとなりました。
LPIAT1は生体膜リン脂質の一種であるホスファチジルイノシトール(PI)にアラキドン酸を導入する脂肪酸リモデリング酵素です。実際にLPIAT1を欠損したマウスの肝臓ではアラキドン酸を有するPIの量が著しく減少し、その代わりに通常ではあまり見られないオレイン酸やリノール酸などの他の脂肪酸を有する異常なPI分子種が増加していました。詳細な解析からLPIAT1欠損において、PIそのものの合成活性が亢進していること、さらにLPIAT1欠損により増加するこれら異常なPI分子種は細胞内で非常に不安定であり、合成されたのちに速やかに分解されることを見出しました。このPIの分解にはホスホリパーゼCという酵素が関わり、PIが分解されるとジアシルグリセロールへと変換されます。ジアシルグリセロールは中性脂質合成の直接の原料となることから、LPIAT1欠損によるPIの合成と分解の同時亢進が、中性脂質合成の原料の異常供給を引き起こし、中性脂質が蓄積するという全く新しい脂肪肝発症機構が明らかになりました(図3)。
最後に、過去にフィンランドおよびイタリアにおける肥満患者の肝臓に対して行った疫学調査サンプルを再解析しました。その結果、LPIAT1のSNPを持つヒトの肝臓ではLPIAT1の発現が低下していることが確認されました。さらにLPIAT1のSNPを持つヒトの肝臓では、マウス同様アラキドン酸を含有するPI量が減少することが明らかになりました。
今後の展開
NAFLDに対する治療法は未だ確立されておらず、脂肪肝発症につながる分子機構の全貌の解明とその分子機構に基づいた治療薬の開発が待たれています。本研究により、NAFLDのリスク遺伝子として注目されているLPIAT1のSNPが脂肪肝の発症と増悪を引き起こす分子機構を解明することができました。さらに、LPIAT1欠損マウスを用いた解析から、PIから中性脂質が合成されるという全く新しい中性脂質合成経路の存在を明らかにしました。今後、本研究により見出された脂肪肝発症機構を標的とした治療薬の開発が期待されます。
発表雑誌
- 雑誌名:
- 「Gut」(2020年4月6日オンライン版掲載)
- 論文タイトル:
- LPIAT1/MBOAT7 depletion increases triglyceride synthesis fueled by high phosphatidylinositol turnover
- 著者:
- Yuki Tanaka, Yuta Shimanaka, Andrea Caddeo, Takuya Kubo, Yanli Mao, Tetsuya Kubota, Naoto Kubota, Toshimasa Yamauchi, Rosellina Margherita Mancina, Guido Baselli, Panu K. Luukkonen, Jussi Pihlajamäki, Hannele Yki-Järvinen, Luca Valenti, Hiroyuki Arai, Stefano Romeo and Nozomu Kono
- DOI番号:
- 10.1136/gutjnl-2020-320646
- アブストラクトURL:
- http://dx.doi.org/10.1136/gutjnl-2020-320646
用語解説
- (注1)非アルコール性脂肪性肝疾患(Non Alcoholic Fatty Liver Disease : NAFLD):
- 肝細胞に中性脂質が蓄積して肝障害を引き起こす病態を脂肪性肝疾患と呼ぶ。脂肪性肝疾患のうち、飲酒歴のない人が発症するものを非アルコール性脂肪性肝疾患(NAFLD)と呼ぶ。NAFLDは単純性脂肪肝と炎症や線維化を伴い、肝硬変や肝がんへと進行する危険がある非アルコール性脂肪性肝炎の総称である。日本での非アルコール性脂肪性肝疾患の有病率は約30%程度であると推定されており、そのうち10~20%が非アルコール性脂肪性肝炎まで進行していると推定される。
- (注2)Lysophosphatidylinositol acyltransferase 1(LPIAT1)
- リン脂質に脂肪酸を導入するアシルトランスフェラーゼ酵素群の一種。ホスファチジルイノシトールにω6脂肪酸の一種であるアラキドン酸を選択的に導入する活性を有している。Membrane bound O-acyltransferase 7 (MBOAT7)とも呼ばれる。
- (注3) 一塩基多型(single nucleotide polymorphism:SNP):
- 生物種集団のゲノム塩基配列中に一塩基が変異した多様性が見られ、その変異が集団内で1%以上の頻度で見られる時、これを一塩基多型(SNP)と呼ぶ。遺伝子領域にあるSNPの中には酵素やタンパク質の量や機能に違いを生み出すものがあり、この違いが疾患へのかかりやすさなどの個人差を生み出す要因になりうる。
- (注4) ゲノムワイド関連解析(GWAS):
- ある集団に存在する個体のあいだの形質の違いとDNA配列の違いとの関連をゲノム全体にわたり調べることにより、一塩基多型(SNP)と疾患や量的形質との関連を統計的に調べる方法論。
- (注5) ホスファチジルイノシトール (PI):
- 生体膜を構成するリン脂質の一種で、極性頭部にイノシトール環を有する。全リン脂質分子種の中で約10%を占める。
- (注6)リン脂質脂肪酸リモデリング酵素
- 生体膜の主要なリン脂質にはグリセロールに脂肪酸が2つと極性頭部が結合した構造をしている。リン脂質はグリセロール3リン酸に脂肪酸が2つ結合し、その後、極性頭部が付加されて合成される。その後のリン脂質の極性頭部の種類(リン脂質クラス)に応じて脂肪酸鎖の入れ替えがおこり(脱アシル化、再アシル化)、各リン脂質クラスは特徴的な脂肪酸鎖をもつようになる。この脂肪酸鎖の入れ替えの過程を担う酵素をリン脂質脂肪酸リモデリング酵素と呼ぶ。
お問い合わせ先
研究に関するお問い合わせ先
所属 役職:東京大学大学院薬学系研究科 准教授
氏名:河野 望
TEL:03-5841-4722
Email:nozomu"AT"mol.f.u-tokyo.ac.jp
AMED事業に関するお問い合わせ先
国立研究開発法人日本医療研究開発機構(AMED)
シーズ開発・研究基盤事業部 革新的先端研究開発課TEL:03-6870-2224
E-mail:kenkyuk-ask"AT"amed.go.jp
※上記の"AT"は@に置き換えてください。
掲載日 令和2年5月1日
最終更新日 令和2年5月1日


