成果情報 細胞内での標的タンパク質機能解析に適した新たなケミカルノックダウンシステムを開発―迅速かつ可逆的な標的タンパク質の発現量制御が可能―
成果情報
愛媛大学
関西医科大学
名古屋工業大学
日本医療研究開発機構
発表概要
このたび、愛媛大学プロテオサイエンスセンター山中聡士特定研究員、愛媛大学大学院理工学研究科博士前期課程1年庄屋祐希さん、愛媛大学プロテオサイエンスセンター澤崎達也教授、関西医科大学附属生命医学研究所福田尚代助教、名古屋工業大学大学院工学研究科柴田哲男教授らの研究グループは、細胞内標的タンパク質の機能解析に利用可能な新たなケミカルノックダウンシステムの開発に成功しました。
細胞内の標的タンパク質の存在量を制御することは、生体内におけるタンパク質の働きを知るための強力な解析手法です。本研究では、低分子薬剤であるサリドマイドやその誘導体の処理によって細胞内の標的タンパク質分解を誘発する短いアミノ酸タグ配列S4Dタグの開発を行いました。S4Dシステムは、低分子薬剤依存的に標的タンパク質の発現量を迅速且つ可逆的に変化させることが可能であり、標的タンパク質を詳細に解析できることから大いに注目されています。S4Dシステムの開発により、タンパク質研究への大きな貢献が期待できます。
この研究成果に関する論文は、2020年9月18日付けでCommunications Biology誌に掲載されました。
発表内容
1.背景
タンパク質は生物の生理現象を制御するために様々な機能を有しており、細胞内では多くのタンパク質の機能は複雑に絡み合っています。したがって、タンパク質の機能の解明は複雑に制御されている生理現象の理解に繋がり、疾患発症のメカニズムの解明や治療薬標的タンパク質の特定などに応用できます。標的タンパク質の機能解析を行う上で、標的タンパク質の存在量を制御することは強力な手法であります。特に、低分子薬剤を用いたケミカルノックダウンシステム1)は、投与した低分子薬剤依存的に標的タンパク質の存在量を減少させることが可能であり、迅速かつ可逆的なノックダウンシステムとして注目されています。
これまで、植物ホルモンであるオーキシンを用いたAIDシステムをはじめとする多くのケミカルノックダウンシステムが開発・利用されてきました。しかしながら、標的タンパク質へ付加するアミノ酸配列の長さや同時に分解誘導のためのタンパク質を発現させる必要性などの改善すべき点がありました。そのため、付加するアミノ酸配列の長さ等を改善したケミカルノックダウンシステムが求められていました。
2.研究成果
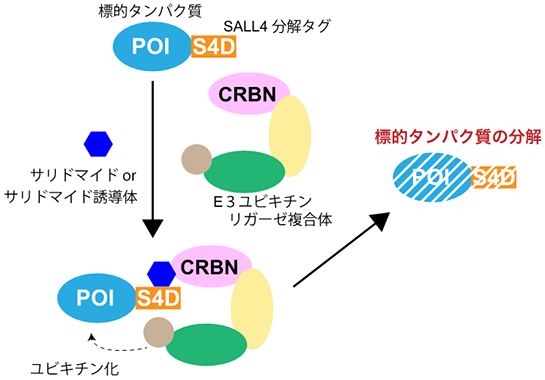
愛媛大学プロテオサイエンスセンターの澤崎達也教授らの研究グループは、今回、関西医科大学、名古屋工業大学の協力を得て、サリドマイドやその誘導体(Immunomodulatory drug/IMiD2))依存的に標的タンパク質を分解可能なS4D(SALL4 Degron)システムを開発しました(図1)。E3ユビキチンリガーゼ3)の構成因子のひとつであるサリドマイド結合タンパク質CRBN4)によって分解誘導されるタンパク質であるSALL4の結合領域のマッピングにより、標的タンパク質の分解誘導に必要な28アミノ酸から成る短いタグ配列を決定しました。SALL4分解タグ5)を様々なタンパク質へ融合させ、分解速度、可逆性、サリドマイド誘導体により分解されるタンパク質の選択性を解析しました。その結果、S4Dシステムは迅速かつ可逆的に細胞内における様々なタンパク質の分解が可能であり、内在性の標的タンパク質の解析に有用であることが確認されました。また、サリドマイド代謝産物である5位水酸化サリドマイド6)を用いることにより、さらに迅速かつ特異的に標的タンパク質の分解誘導をできることを明らかにしました。これらの結果から、S4Dシステムは標的タンパク質に短いタグ配列を付加するだけで、迅速かつ選択的に低分子薬剤依存的な標的タンパク質の分解誘導が可能であり、細胞内シグナル伝達解析などの解析に有用であることが確認されました。
3.波及効果
S4Dシステムは高い分解誘導能を有し、標的タンパク質分解に必要なE3リガーゼであるCRBNは様々なヒト培養細胞内に広く発現していることから、ヒト培養細胞を用いた標的のタンパク質の解析に利用しやすいケミカルノックダウンシステムであると言えます。また、用いる誘導体に依存して分解強度や選択性を調節することが可能であり、迅速かつ可逆的なタンパク質分解であるため、細胞内シグナル伝達の解析に利用可能です。実際に、論文内においては、免疫および炎症応答に極めて重要なNF-kBシグナル伝達の解析に利用可能であることが示されました。これらの結果から、S4Dシステムはタンパク質機能解析に関する幅広い分野での利用が期待されます。
4.研究体制と支援について
本研究は、愛媛大学プロテオサイエンスセンターを中心に、関西医科大学附属生命医学研究所、名古屋工業大学大学院工学研究科との共同研究としておこなわれました。
また、研究の実施にあたっては、日本学術振興会(JSPS)科学研究費助成事業、新学術領域研究「数理解析に基づく生体シグナル伝達システムの統合的理解」、武田科学振興財団、日本医療研究開発機構(AMED)創薬等ライフサイエンス研究支援基盤事業(BINDS)「コムギ無細胞系による構造解析に適した複合体タンパク質生産・調製技術と低分子抗体作製技術の創出」の支援を受けました。
5.論文タイトルと著者
- タイトル:
- An IMiD-induced SALL4 degron system for selective degradation of target proteins
(和訳)標的タンパク質の選択的分解のためのIMiD誘導性SALL4デグロンシステム - 著者:
- 山中聡士(愛媛大学)、庄屋祐希(愛媛大学)、松岡沙耶(愛媛大学)、福田尚代(関西医科大学)、柴田哲男(名古屋工業大学)、澤崎達也*(愛媛大学)(*責任著者)
- 掲載誌:
- Communications Biology
- URL:
- https://www.nature.com/articles/s42003-020-01240-5
- DOI:
- 10.1038/s42003-020-01240-5
- 掲載日:
- 2020年9月18日(金)
用語説明
- 1)ケミカルノックダウン
- 低分子薬剤などの化学物質を用いて、ユビキチン・プロテアソーム系を利用して標的タンパク質を分解誘導する手法。
- 2)Immunomodulatory drug/IMiD
- サリドマイドやその誘導体の総称であり免疫調整薬とも呼ばれる。イカロスやアイオロスと呼ばれるタンパク質の分解を引き起こし、多発性骨髄腫などの血液がんに対する治療薬として世界中で使用されている。
- 3)E3ユビキチンリガーゼ
- タンパク質のユビキチン化を引き起こす酵素。細胞内でユビキチン化されたタンパク質はプロテアソームによって分解される。
- 4)CRBN(cereblon)
- サリドマイドやその誘導体の薬剤が結合し、薬剤依存的に結合するタンパク質を分解誘導できるE3ユビキチンリガーゼ。
- 5)SALL4分解タグ
- IMiD依存的にCRBNと相互作用するために必要なSALL4の領域。標的のタンパク質に付加することで、IMiD依存的なタンパク質分解を誘導することができる。
- 6)5位水酸化サリドマイド
- ヒトの代謝酵素シトクロムP450により、サリドマイドのフタルイミド環5位に水酸基(-OH基)が付加されたサリドマイドの生体内代謝産物。サリドマイドやその誘導体と比較して、より強力にSALL4のタンパク質分解を誘導する。
お問い合わせ先
研究内容に関すること
愛媛大学プロテオサイエンスセンター
教授 澤崎達也(さわさきたつや)
TEL:089-927-8530
E-mail:sawasaki“AT”ehime-u.ac.jp
関西医科大学附属生命医学研究所
助教 福田尚代(ふくだひさよ)
TEL:072-804-2624
E-mail:fukudahs“AT”hirakata.kmu.ac.jp
名古屋工業大学大学院工学研究科
教授 柴田哲男(しばたのりお)
TEL:052-735-7543
E-mail:nozshiba“AT”nitech.ac.jp
AMED事業について
日本医療研究開発機構(AMED)創薬事業部医薬品研究開発課
創薬等ライフサイエンス研究支援基盤事業(BINDS)
TEL:03-6870-2219 FAX:03-6870-2244
E-mail:20-DDLSG-16“AT”amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
関連リンク
掲載日 令和2年10月7日
最終更新日 令和2年10月7日


