K+チャネルの病因性変異による機能変調機構を解明―溶液NMR法を活用した動的構造の解析により明らかに―
成果情報
次世代天然物化学技術研究組合
国立研究開発法人理化学研究所
国立研究開発法人日本医療研究開発機構
理化学研究所(理研)生命機能科学研究センター生体分子動的構造研究チームの嶋田一夫チームリーダーの研究チームは、カリウムイオン(K+)チャネルの病因性変異によって、K+透過ゲートの構造平衡1)状態が変化することで、K+透過活性が変化するという機能変調機構を明らかにしました。本研究成果は、K+チャネルの病因性変異によって生じる様々な疾病の新規治療戦略の確立、そしてK+チャネルを標的とした医薬品の合理的な分子設計の指針になることが期待できます。
今回、研究チームは、溶液核磁気共鳴(Nuclear Magnetic Resonance, NMR)分光法2)を用いることで、K+チャネルのホットスポット部位の病因性変異が、K+チャネルの細胞内側に位置するイオン透過ゲートの動的構造を変化させることを示し、変異体ではK+を透過できない閉じた構造に構造平衡が遷移することで、K+透過活性が低下する機構を明らかとしました。また、K+チャネルの変異体の網羅的解析から膜貫通ヘリックス同士の接触部位が構造平衡の制御に重要であること、そして細胞内ゲートの構造平衡はチャネル電流解析においてミリ秒の時間領域で生じるK+透過状態-非透過状態の活性の変化と対応していることを明らかにしました。
研究開発のポイント
- 溶液NMRを用いてK+チャネルの開閉にかかわる構造平衡を同定した。
- K+チャネルのホットスポット部位の病因性変異が、イオン透過ゲートの動的構造を変化させ、K+透過活性が低下することを示した。
研究概要
細胞内外にはK+やナトリウムイオン(Na+)等のイオン濃度勾配が生じており、これらの濃度勾配は細胞内側が負に帯電した膜電位を生じさせます。膜を介したこれらのイオンの輸送は、膜電位の変化を介して細胞の興奮性の制御や神経伝達などの重要な生理機能を司ります。K+チャネルは、K+の濃度勾配に応じた輸送を行う膜タンパク質です。膜電位の変化やシグナル伝達物質の結合などの様々な刺激に応じて、K+を透過する開構造と、透過しない閉構造との間を遷移することにより、K+の透過量を制御します。ミスセンス変異3)によってK+チャネルの開閉に変調が生じると、様々な疾病を引き起こすことが知られています。このことは、周期性失調症やQT延長症候群、てんかんなどの患者の遺伝子には、K+チャネルの様々なミスセンス変異が見出されていることからも支持されます。
K+チャネルの立体構造、ならびに開閉の分子機構は主にX線結晶構造解析4)によって解析が行われてきました。これらの解析から、K+透過路を形成する膜貫通領域は、3本の膜貫通ヘリックス(アウターヘリックス、ポアヘリックス、インナーヘリックス)からなるサブユニットが対称な4量体構造を形成することで機能し、K+透過路の立体構造はK+チャネル間で高度に保存されていること知られています(図1A)。また、K+透過路には、細胞外側においてK+の選択的透過を担う選択フィルターと、細胞内側においてインナーヘリックス同士が会合しK+の透過を阻む細胞内ゲートの2か所のゲート部位が存在し、これらのゲートが協奏的にK+透過を制御していることが提唱されていました。
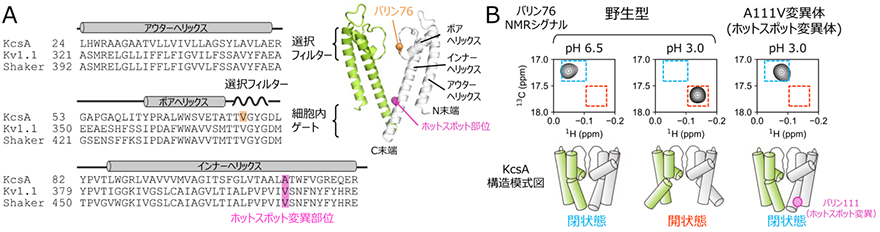
様々なK+チャネルの変異体解析から、変異導入に伴いK+透過活性が変化する「ホットスポット部位」が存在することが知られています(図1A)。特にヒト由来の電位依存性K+チャネルKv1.1のホットスポット部位である残基番号408のバリン残基は、一型周期性失調症の患者において変異が見出されており、アラニンへの変異によってK+透過活性が低下することが報告されていました。したがって、これらのホットスポット部位の変異によってK+透過活性が低下する機構を理解することは、これらのミスセンス変異が原因となって生じる疾患に対する新規治療戦略の確立、そしてK+チャネルの活性を調節する医薬品の開発を実現するうえで重要です。一方で、詳細な解析が行われているKv1.2-Kv2.1キメラチャネルの結晶構造解析から、このホットスポット部位の変異体の立体構造が明らかにされていますが、野生型との立体構造の違いはわずかであり、ホットスポット変異によってなぜK+透過活性の低下が生じるのか、その詳細な構造機構は明らかではありませんでした。
研究チームは、K+チャネルは開構造と閉構造との間の動的な構造平衡状態にあることに着目し、結晶構造に代表されるような静的構造のスナップショットの比較だけからは、ホットスポット変異による機能変調機構を理解することは困難であると考えました。そこで、K+チャネルの溶液環境における動的構造情報を得ることができるNMR分光法を用いて、変異によるK+チャネルの動的構造への影響を調べました。研究対象としてpH依存性K+チャネルKcsA5)を用い、ホットスポット部位に相当する残基番号111のアラニン残基をバリン残基に置換したホットスポット変異体(A111V変異体)におけるNMRスペクトルの変化を解析しました。KcsAの選択フィルター、ならびに細胞内ゲートの構造平衡状態を鋭敏に反映することが知られている、残基番号76のバリン残基のNMRシグナルに着目し、野生型とホットスポット部位の変異体のNMRスペクトルを比較しました(図1B)。その結果、ホットスポット部位の変異体では野生型が開口状態となる酸性条件においても、細胞内ゲートが閉じた構造が形成されていることが明らかとなりました。このことは、ホットスポット変異がKcsAの動的構造を変化させ、細胞内ゲートが閉じた状態に構造平衡を遷移させていることを示しています。
さらに、膜貫通領域の変異が細胞内ゲートの構造平衡に与える影響を調べるために、膜貫通領域の疎水性アミノ酸の変異体を網羅的に解析し、ホットスポットの変異体の場合と同様に、細胞内ゲートの構造平衡を遷移させる変異体を探索しました(図2A)。その結果、残基番号91のバリン、106のバリン残基などを、イソロイシンのようにより嵩高いアミノ酸に置換した変異体において、細胞内ゲートが閉じた状態に構造平衡が遷移していること、そしてこれらの変異導入部位は膜貫通ヘリックス同士が接触する部位に相当していることを明らかにしました。細胞内ゲートが閉じた状態と開いた状態の立体構造の詳細な比較、ならびに他の変異体を用いた検証実験から、これらの膜貫通ヘリックスへの変異導入は、細胞内ゲートが開いた構造における立体障害を増大させ、細胞内ゲートが閉じた状態へと構造平衡を遷移させているということが分かりました。
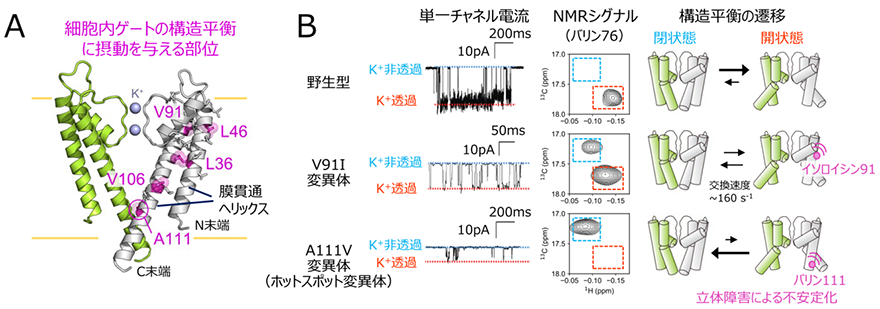
さらに、構造平衡の遷移によってK+透過活性が低下する機構をより詳細に調べるために、野生型、ホットスポットの変異体、ならびに新たに見出した膜貫通領域の変異体を用いて、脂質平面膜上における単一チャネル電流を比較しました(図2B)。その結果、単一チャネル電流解析においてミリ秒の時間領域で生じるK+非透過状態の存在割合が、NMRシグナル強度比から算出された細胞内ゲートが閉じた状態の存在割合と強く相関していることを見出しました。このことは、細胞内ゲートの構造平衡の遷移は、ミリ秒の時間領域で生じるK+透過状態-非透過状態の活性の変化と対応していること示しています。
以上の結果から、K+チャネルのホットスポットへの変異は、膜貫通ヘリックス同士の接触部位における立体障害を増大させることで、細胞内ゲートの構造平衡を閉じた状態へ遷移させていることを明らかにしました。そして、この細胞内ゲートの構造平衡の遷移が、ミリ秒の時間領域で生じるK+非透過状態の増大を引き起こすことで、K+透過活性を低下させているという機能変調機構を明らかにしました。
本研究から明らかとなったK+チャネルの機能変調機構は、K+チャネルのミスセンス変異によって生じる疾病に対する新規治療法の確立、ならびにK+チャネルの活性を制御する医薬品の合理的な設計に貢献できると考えます。また、本研究からその重要性が示された、膜貫通ヘリックス同士の接触部位に対して作用する医薬品を設計するには、分子サイズが大きく、広い構造領域を認識することが可能な中分子医薬品6)を用いた創薬戦略が有効です。本研究で得られた知見は、このような中分子創薬を実現するうえでの指針となるものであり、溶液NMR分光法を用いたタンパク質の動的構造の解析は中分子創薬の基盤技術となることが期待されます。
なお、本研究成果は、2020年10月14日に英国科学誌『Nature Communications』オンライン版に掲載されました。
用語解説
- 1)構造平衡
- タンパク質の構造が一形ではなく、複数の異なる構造間の交換状態にあること。
- 2)核磁気共鳴(Nuclear Magnetic Resonance, NMR)分光法
- 原子の核スピンは、静磁場中におかれるとスピン量子数と磁気回転比にしたがって複数のエネルギー準位に分裂する。核磁気共鳴法は、静磁場中で生じたエネルギー準位間の遷移を、ラジオ波を照射したときの共鳴現象から観測することで、物質の分子構造や運動性を解析する手法である。
- 3)ミスセンス変異
- 遺伝子内の塩基置換が生じることでコドン内の塩基配列が変化し、他のアミノ酸をコードするようになる点突然変異の一種。
- 4)X線結晶構造解析
- 結晶化させた試料にX線を照射したときの回折パターンから電子密度分布を取得し、分子の立体構造を解析する方法。
- 5)KcsA
- 放線菌Streptomyces lividans由来のpH依存性K+チャネル。中性条件ではK+を透過しない閉状態をとり、pH5.0以下の酸性条件においてK+を透過する開状態をとる。
- 6)中分子医薬品
- 低分子医薬品と、抗体医薬品などの高分子医薬品の中間に位置付けられ、分子量が数百から数千程度の領域にある医薬品群。タンパク質間相互作用のように広い相互作用面を標的とすることが可能である。
特記事項
※本研究は国立研究開発法人日本医療研究開発機構(AMED)「次世代治療・診断実現のための創薬基盤技術開発事業(革新的中分子創薬技術の開発)」の支援によって行われました。
論文情報
- 雑誌名
- Nature Communications volume 11, Article number: 5168 (2020)
- 論文タイトル
- Conformational equilibrium shift underlies altered K+ channel gating as revealed by NMR
- 著者
- Yuta Iwahashi, Yuki Toyama, Shunsuke Imai, Hiroaki Itoh, Masanori Osawa, Masayuki Inoue & Ichio Shimada
- DOI番号
- 10.1038/s41467-020-19005-3
お問い合わせ先
内容に関するお問い合わせ
国立研究開発法人理化学研究所 生命機能科学研究センター
チームリーダー 嶋田一夫(しまだいちお)
E-mail:ichio.shimada“AT”riken.jp
AMEDの事業に関するお問い合わせ
国立研究開発法人日本医療研究開発機構
創薬事業部 医薬品研究開発課
次世代治療・診断実現のための創薬基盤技術開発事業担当
E-mail:jisedai-med“AT”amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
関連リンク
掲載日 令和2年11月25日
最終更新日 令和2年11月25日


