グルコーストランスポーターGlut1は、脳グリオーマ微小環境において神経周囲浸潤をともなったびまん性浸潤を制御する
成果情報
岐阜大学
日本医療研究開発機構
研究成果のポイント
- 集塊を作らず、正常脳にびまん性に浸潤するびまん性神経膠腫(グリオーマ)のマウスモデルを樹立しました。
- グルコーストランスポーター(Glut1)(※1)依存性の解糖スイッチは、神経細胞周囲浸潤(神経細胞への付着と接触)を制御しているメカニズムを示しました。
- Glut1阻害と代謝に基づく新規画像撮影法は、抗侵襲診断及び治療に有用である可能性を示しました。
概要説明
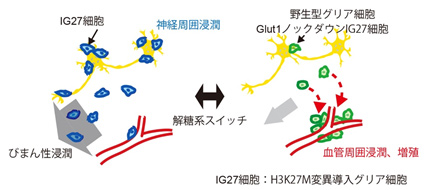
今回、岐阜大学大学院医学系研究科脳神経外科学宮居雅文大学院生、同先端画像開発講座の兵藤文紀特任准教授、同放射線科松尾政之教授と同腫瘍腫瘍病理学富田弘之准教授らのグループは、脳という他の臓器と大きく異なる環境において、正常の脳組織内に個々の神経膠腫(グリオーマ)(※2)細胞が集塊を作ることなく、バラバラと浸潤していく、いわゆる「びまん性浸潤」マウスモデルの作製に成功しました。この「びまん性浸潤(※3)」の特徴の一つである神経周囲浸潤(perneuronal satellitosis, PS)(※4)は、80年以上前に病理学者シェーラーによって提唱されたものの、そのメカニズムは不明でありました。本研究では、腫瘍の代謝に注目し、神経周囲浸潤のメカニズムの一端を明らかとしました(図1)。この代謝変化は、新規治療標的になるだけでなく、従来描出不可能であった「びまん性浸潤」の伸展範囲の描出に超偏極イメージング装置dynamic nuclear polarization(DNP)-MRI(※5)を用いた生体酸化還元(レドックス)(※6)代謝画像が有用である可能性を示しました。
なお、本件研究成果は、令和2年10月30日に欧州神経腫瘍学雑誌のオープン・アクセス誌である「Neuro-Oncology Advances」に掲載されました。
背景
神経膠腫(グリオーマ)は腫瘍周囲の正常組織内へ浸潤する特徴(びまん性浸潤)を示すことが多く、外科手術で切除しきれないことが予後不良の原因となっています。
ヒストンH3K27M(※7)変異は脳幹部小児びまん性グリオーマに頻出の遺伝子変異です。その形態はびまん性浸潤を呈し、従来のMRIでは広がりの描出が困難です。
研究内容と成果
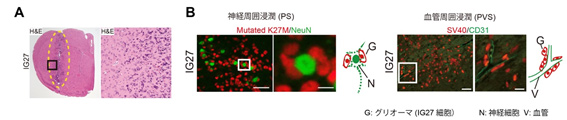
ヒストンH3K27M変異を、マウスグリア細胞(※8)へ遺伝子導入しました。確立できたマウスH3K27M変異導入グリア細胞(IG27細胞)(※9)をマウス頭蓋内へ移植し、PSを伴うびまん性グリオーマのマウスモデル作成に成功しました(図2)。このモデルは80年前に提唱されたシェーラーの2次構造(※10)を病理組織学的に再現しました。
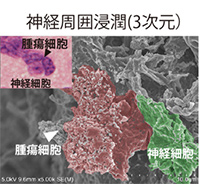
腫瘍細胞と神経細胞の接着をより詳細に検証するために、電子顕微鏡を用いて観察したところ、グリオーマのPSを初めて3次元で撮影することに成功しました(図3)。
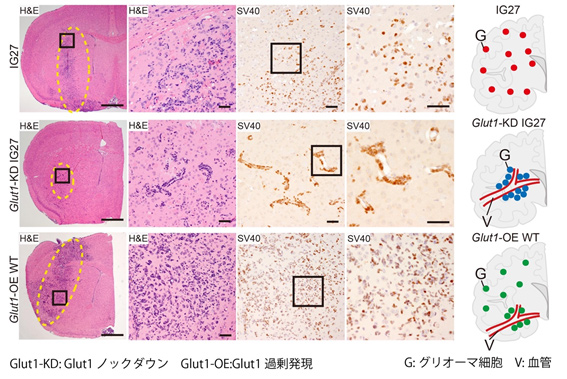
IG27細胞の網羅的遺伝子解析のためマイクロアレイを行ったところ、IG27細胞は野生型細胞と比較してグルコーストランスポーター1(Glut1)の上昇を認めました。shRNA(※11)を用いたGlut1ノックダウンIG27細胞、発現プラスミドを用いたGlut1発現過剰野生型細胞を作製し、マウス脳に移植した結果、Glut1抑制IG27細胞は通常IG27細胞と比較し、生着腫瘍細胞数が有意に減少し、PSの頻度が有意に減少しました。さらにGlut1発現過剰野生型細胞でPSの再現性を認めました。これによりGlut1がPSを制御していることが示されました。
また、ヒトグリオーマ組織66例でGLUT1の発現を免疫組織化学で評価したところ、44例66.7%で陽性となり、多変量解析の結果、GLUT1陽性症例で有意に無増悪生存期間が短縮しました(図4)。
さらに、IG27グリオーマモデルを用いてdynamic nuclear polarization(DNP)-MRIによるレドックス代謝の評価を行いました。その結果、従来のMRIによる形態的な診断では描出できなかったびまん性浸潤をDNP-MRIによるレドックス代謝で検出が可能となりました(図5)。
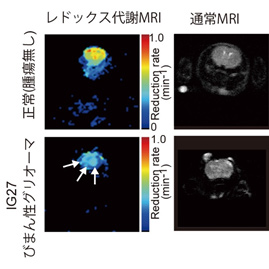
今後の展開
本研究グループの樹立したびまん性グリオーマモデルは、遺伝子異常に基づき、かつ病理組織学的特徴を再現した貴重なモデルです。このモデルを活かし、さらに浸潤のメカニズムを明らかにしていきます。また、岐阜大学には最先端の代謝イメージング装置が開発されており、それらは早期発見および術前評価、早期治療効果の判別において非侵襲的バイオマーカーとなり得ます。今後、臨床用装置開発に展開する予定です。
研究協力体制
本研究は、岐阜大学医学部腫瘍病理学、脳神経外科学、放射線医学、救急災害医学、寄生虫学・感染学、獣医学部、岐阜大学医学部附属病院先端医療・臨床研究推進センターの研究協力体制で実施したものです。
本研究への支援
本研究は、国立研究開発法人日本医療研究開発機構(AMED)次世代がん医療創生研究事業(代表 松尾政之)、日本学術振興会科学研究費助成事業、がんの子どもを守る会の支援を受けました。
発表論文
- 掲載誌
- Neuro-Oncology Advances
- 論文タイトル
- Glucose transporter Glut1 controls diffuse invasion phenotype with perineuronal satellitosis in diffuse glioma microenvironment
- 著者
- Masafumi Miyai#, Tomohiro Kanayama#, Fuminori Hyodo#, Takamasa Kinoshita, Takuma Ishihara, Hideshi Okada, Hiroki Suzuki, Shigeo Takashima, Zhiliang Wu, Yuichiro Hatano, Yusuke Egashira, Yukiko Enomoto, Noriyuki Nakayama, Akio Soeda, Hirohito Yano, Akihiro Hirata, Masayuki Niwa, Shigeyuki Sugie, Takashi Mori, Yoichi Maekawa, Toru Iwama, Masayuki Matsuo, Akira Hara, and Hiroyuki Tomita* (#、共同第一著者)(*、責任著者)
- DOI番号
- 10.1093/noajnl/vdaa150
- URL
- https://academic.oup.com/noa/advance-article/doi/10.1093/noajnl/vdaa150/5944068
用語解説
- (※1)グルコーストランスポーター1(Glut1)
- グルコーストランスポーター1。細胞膜上に存在しグルコースを取り込む働きをする。
- (※2)神経膠腫(グリオーマ)
- 悪性の脳腫瘍の一つで、グリア(神経膠)細胞から発生すると考えられている。
- (※3)びまん性浸潤
- 一般的に、1~数個の腫瘍細胞が大きな集塊を形成せず、周囲の正常組織に隙間を縫うように進んでいく像のこと。周囲組織との境界がわかりづらい特徴を示す。
- (※4)神経周囲浸潤(perneuronal satellitosis, PS)
- 神経細胞(ニューロン)と接触、あるいは神経細胞間の隙間に浸潤すること。
- (※5)超偏極イメージング装置dynamic nuclear polarization (DNP)-MRI (DNP-MRI)
- フリーラジカルのエネルギ-を利用してMRIの感度を向上する動的確偏極(Dynamic Nuclear Polarization)を応用したMRIによる生体代謝イメージング。
- (※6)生体酸化還元(レドックス)
- 還元(reduction)と酸化(oxidation)を組み合わせた単語。酸化還元状態のことを表す。
- (※7)ヒストンH3K27M
- ヒストンH3のヒストンテールから27番目のリジンがメチオニンに置換された変異。2016年にWHOの中枢神経系腫瘍分類でびまん性正中グリオーマ(diffuse midline glioma)の分子的特徴と定義された。
- (※8)グリア細胞
- 神経膠細胞ともいう。神経細胞(ニューロン)と血管の間で動き、栄養の供給や神経伝達物質の受け渡しを行っています。
- (※9)マウスH3K27M変異導入グリア細胞(IG27細胞)
- ヒストンH3K27M変異を遺伝子導入したマウスグリア細胞。本研究にて作製した細胞。マウス頭蓋内に移植すると、びまん性浸潤を示すグリオーマが発生する。
- (※10)シェーラーの2次構造
- 1938年にドイツの病理学者シェーラー氏により提唱されたグリオーマが広がる際に認められる特徴的な病理所見。神経周囲浸潤、皮質表面での増殖、血管周囲浸潤、白質浸潤などが含まれる。
- (※11)shRNA
- 短鎖ヘアピンRNA。shRNA発現プラスミドベクターを用いれば、長期的な抑制効果を発揮することができ、ターゲット遺伝子の発現を抑制します。
お問い合わせ先
内容に関するお問い合わせ
岐阜大学大学院医学系研究科腫瘍病理
富田 弘之
TEL:058-230-6225
E-mail:h_tomita"AT"gifu-u.ac.jp
AMEDの事業に関すお問い合わせ
国立研究開発法人日本医療研究開発機構(AMED)
創薬事業部 医薬品研究開発課
TEL:03-6870-2311
E-mail:cancer"AT"amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
関連リンク
掲載日 令和2年12月1日
最終更新日 令和2年12月1日


