成果情報 KDM4C遺伝子のコピー数変異と統合失調症および自閉スペクトラム症それぞれとの関連を明らかに―発症に至る病態にヒストンメチル化修飾の変化が関与する可能性を示す―
成果情報
名古屋大学
日本医療研究開発機構
名古屋大学大学院医学系研究科精神医学の尾崎紀夫教授、久島周病院講師、大学院生の加藤秀一らの研究グループは、統合失調症と自閉スペクトラム症(ASD)の患者さんを対象にKDM4C遺伝子※1のゲノムコピー数変異(copy number variant;CNV)※2を解析した結果、KDM4C遺伝子のCNVと、両疾患との間に遺伝統計学的な関連があること、KDM4C遺伝子のCNVのうち欠失と、統合失調症に関連があることを明らかにしました。さらに、KDM4C遺伝子の欠失を持つ患者さんから樹立したリンパ芽球様細胞株※3を解析した結果、KDM4Cタンパク質の発現が低下し、ヒストンメチル化修飾※4のパターンが変化していることを示唆する結果が得られました。
統合失調症とASDは、患者さんの自他覚的な症状に基づく精神医学的な診断基準により、異なる疾患として区別されていますが、最近の疫学研究から両疾患の病因・病態は一部重複している可能性が示唆されています。これまでの研究から、統合失調症とASDの発症に至る病態に、ヒストンメチル化修飾などのエピジェネティック※5な機構が関与していることが明らかとなっています。ヒストンメチル化修飾を調節するKDM4C遺伝子は、神経幹細胞※6の分化の調節に関わることや、マウス実験で多動、固執性や記憶・学習障害など両疾患に関連する表現型を認めることが報告されており、神経発達に重要な役割を果たしていることが推測されます。本研究の結果から、KDM4C遺伝子の欠失によって起こるヒストンメチル化修飾の変化によって、統合失調症発症に至る病態の一部を説明できる可能性が示されました。本研究成果は、統合失調症およびASDの病態解明に繋がることが期待されます。
本研究成果は、英国の科学雑誌『Translational Psychiatry』(2020年12月5日付の電子版)に掲載されました。本研究結果は、革新的技術による脳機能ネットワークの全容解明プロジェクト(革新脳)、脳科学研究戦略推進プログラム(発達障害・統合失調症等の克服に関する研究)の支援を受けて行われました。
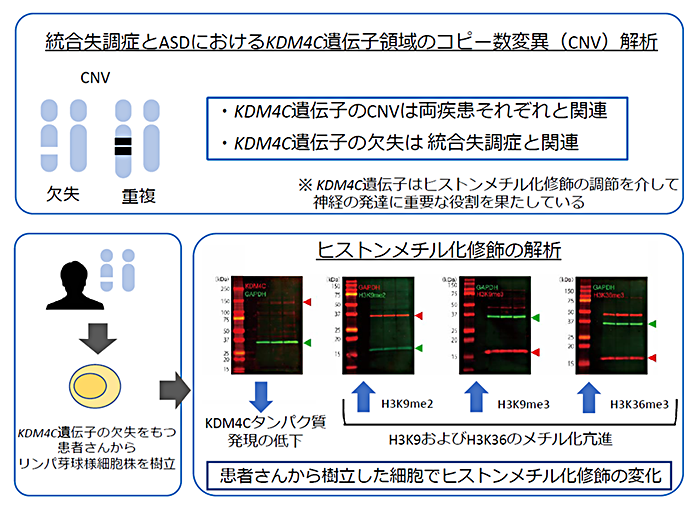
ポイント
- KDM4C遺伝子のコピー数変異(CNV)と、統合失調症および自閉スペクトラム症(ASD)それぞれとの間に遺伝統計学的な関連があることを明らかにしました。
- KDM4C遺伝子のCNVのうち欠失と統合失調症との関連を明らかにしました。
- KDM4C遺伝子のCNVを持つ統合失調症の患者さんから樹立したリンパ芽球様細胞株を用いて、ヒストンメチル化修飾の変化を調べたところ、ヒストンH3タンパク質のN末端から9番目のリジン残基(H3K9)およびH3K36のメチル化が亢進していることが示唆されました。
- 本研究成果は、SCZおよびASDの病態解明に繋がることが期待されます。
背景
統合失調症および自閉スペクトラム症(ASD)の診断基準は、患者さんの自覚的なあるいは他覚的な症状に基づいており、病態に基づいた診断法や治療は十分に開発されていないのが現状です。これまでの研究から、両疾患ともに、遺伝要因が比較的強く発症に関与することが知られており、ゲノム解析研究を起点とした病態の解明が求められています。特に、一般人口の中で頻度の稀なバリアント※7は発症への影響が大きいと想定されており、注目されています。これまでの研究から、ヒストンメチル化修飾を調節するKDM4C遺伝子は、神経幹細胞の分化の調節に関わることや、モデルマウスで多動、固執性や記憶・学習障害など両疾患に関連する表現型を認めることが報告されており、神経発達に重要な役割を果たしていることが推測されます。また、KDM4C遺伝子における頻度の稀なバリアントが両疾患に関連することが報告されています。しかしながら、KDM4C遺伝子における頻度の稀なバリアントと両疾患それぞれとの関連について十分には検討されておらず、特に生物学的な影響を調べた研究はこれまでにありませんでした。
研究成果
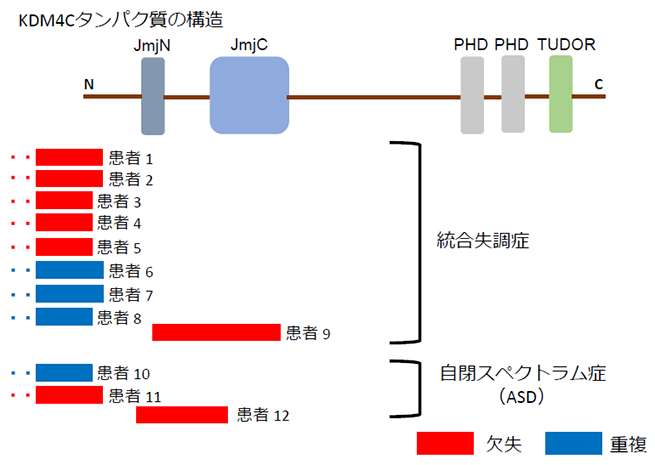
統合失調症とASDの患者さんおよび健常者の方(合計6000人以上)を対象に、KDM4C遺伝子のCNVを解析した結果、12例のKDM4C遺伝子のCNV(統合失調症9例、ASD3例)を同定しました(図1)。KDM4C遺伝子のCNVと、両疾患との間に遺伝統計学的な関連があることを明らかにしました。また、KDM4C遺伝子のCNVのうち8例(統合失調症6例、ASD2例)は欠失で、KDM4C遺伝子の欠失と統合失調症との間にも有意な関連を認めました。患者さんの表現型を評価し、詳しく評価をできた統合失調症の患者さん5人のうち、4人は、十分な量の抗精神病薬を十分な期間投与しても症状が軽快しない、治療抵抗性の患者さんでした。
KDM4C遺伝子の欠失を持つ統合失調症の患者さんから樹立したリンパ芽球様細胞株を用いてKDM4C遺伝子のmRNA発現解析を行った結果、発現が低下していました。また、KDM4Cタンパク質の発現も低下していることが示唆されました。ヒストンメチル化修飾のパターンを調べたところ、ヒストンH3タンパク質のN末端から9番目のリジン残基(H3K9)およびH3K36の高メチル化が示唆されました(図2)。

KDM4C遺伝子の欠失があることで、KDM4Cタンパク質が減少し、ヒストンメチル化修飾のパターンが変化していることが示唆されました。ヒストンメチル化修飾の調節により、様々な遺伝子の発現が調節されていることが知られており、KDM4C遺伝子の欠失によって起こるヒストンメチル化修飾の変化によって、統合失調症の発症に至る病態の一部を説明できる可能性があります。
今後の展開
本研究成果は、KDM4C遺伝子のCNVと統合失調症およびASDそれぞれとの関連を明らかにしたこと、さらにKDM4C遺伝子の欠失とヒストンメチル化修飾パターンに及ぼす潜在的な影響を明らかにし、KDM4C遺伝子の欠失に伴うヒストンメチル化修飾の変化が、統合失調症の発症に寄与する可能性を提示したことです。今後、KDM4C遺伝子のCNVにより、いつどの細胞でメチル化修飾パターンが変化し、どのような遺伝子の発現調節が変化して、両疾患の病態に関与するのかを明らかにしていく必要があります。
用語説明
- ※1 KDM4C遺伝子
- Lysine-specific demethylase 4C(KDM4C)タンパク質をコードする遺伝子。KDM4Cタンパク質は、ヒストンH3タンパク質のアミノ末端から9番目のリジン(H3K9)およびH3K36を脱メチル化する、ヒストンリジン脱メチル化酵素である。H3K9およびH3K36のメチル化を調節することで、遺伝子発現を調節している。近年の研究から、神経発達に重要な役割を果たしていることが示唆されている。
- ※2 ゲノムコピー数変異(CNV)
- 染色体上の特定の領域が、通常2コピーあるところ、1コピー以下(欠失)、あるいは3コピー以上(重複)となっている現象である。CNVの領域に含まれる遺伝子の発現や機能に影響が生じることがあり、一部のCNVは疾患の発症に関与し、その代表例が統合失調症やASDなどの精神疾患である。
- ※3 リンパ芽球様細胞株
- 末梢血由来リンパ球(B細胞)にEBウイルスを感染させることで不死化し、樹立した細胞株。
- ※4 ヒストンメチル化修飾
- ヒストンは5種類のタンパク質からなり、そのうち4種類(H2A、H2B、H3、H4)が2つずつ集合し8量体を形成する。このヒストン8量体にはDNAが約1.65回巻きつけられている。この構造をヌクレオソームという。この構造があることで、真核生物の大きなゲノムを小さな細胞の核の中に収納することができる。ヒストン8量体を構成するタンパク質のアミノ末端部分のアミノ酸にメチル基が1~3つ付くことで、遺伝子の発現調節がされていることが知られている。ヒストンH3タンパク質の、アミノ末端から4番目のリジン(K4)、K9、K27、K36、K79や、ヒストンH4タンパク質のK20などがメチル化されることが知られている。
- ※5 エピジェネティクス
- DNAの塩基配列の変化によらない、遺伝子発現を制御・継承するシステム(機構)のこと。この機構を介して、環境要因によって遺伝子発現が変化することもある。
- ※6 神経幹細胞
- 増殖することで自らの数を増やす自己複製能と、中枢神経系を構成する主要な細胞(神経細胞、アストロサイトおよびオリゴデンドロサイト)への分化能を持った、神経系の未分化な細胞。
- ※7 バリアント
- 多様体ともいう。DNA配列のうち、ヒトの中でもそれぞれによって異なる部分。様々なバリアントの組み合わせにより、私たちヒトの特徴や体質の多様性を生み出している。
発表雑誌
- 掲雑誌名
- Translational psychiatry
- 論文タイトル
- Rare Genetic Variants in the Gene Encoding Histone Lysine Demethylase 4C (KDM4C) and Their Contributions to Susceptibility to Schizophrenia and Autism Spectrum Disorder
- 著者
- Hidekazu Kato1, MD, Itaru Kushima1,2, MD, PhD, Daisuke Mori1,3, PhD, Akira Yoshimi4, PhD, Branko Aleksic1, MD, PhD, Yoshihiro Nawa1, MD, Miho Toyama1, MMedSc, Sho Furuta1, MD, Yanjie Yu1, MD, PhD, Kanako Ishizuka1, MD, PhD, Hiroki Kimura1, MD, PhD, Yuko Arioka1,5, PhD, Keita Tsujimura1,6, PhD, Mako Morikawa1, MD, PhD, Takashi Okada1, MD, PhD, Toshiya Inada1, MD, PhD, Masahiro Nakatochi7, PhD, Keiko Shinjo8, MD, PhD, Yutaka Kondo8, MD, PhD, Kozo Kaibuchi9, MD, PhD, Yasuko Funabiki10, MD, PhD, Ryo Kimura11, MD, PhD, Toshimitsu Suzuki12,13, PhD, Kazuhiro Yamakawa12,13, PhD, Masashi Ikeda14, MD, PhD, Nakao Iwata14, MD, PhD, Tsutomu Takahashi15, 16, MD, PhD, Michio Suzuki15, 16, MD, PhD, Yuko Okahisa17, MD, PhD, Manabu Takaki17, MD, PhD, Jun Egawa18, MD, PhD, Toshiyuki Someya18, MD, PhD and Norio Ozaki1, MD, PhD
- 所属
-
- Department of Psychiatry, Nagoya University Graduate School of Medicine, Nagoya, Japan
- Medical Genomics Center, Nagoya University Hospital, Nagoya, Japan
- Brain and Mind Research Center, Nagoya University, Nagoya, Japan
- Division of Clinical Sciences and Neuropsychopharmacology, Faculty and Graduate School of Pharmacy, Meijo University, Nagoya, Japan
- Center for Advanced Medicine and Clinical Research, Nagoya University Hospital, Nagoya, Japan
- Innovative Research Unit for Developmental Disorders, Institute of Advanced Research, Nagoya University, Nagoya, Japan
- Public Health Informatics Unit, Department of Integrated Health Sciences, Nagoya University Graduate School of Medicine, Nagoya, Japan
- Division of Cancer Biology, Nagoya University Graduate School of Medicine, Nagoya, Japan
- Department of Cell Pharmacology, Nagoya University Graduate School of Medicine, Nagoya, Japan
- Department of Cognitive and Behavioral Science, Graduate School of Human and Environmental Studies, Kyoto University, Kyoto, Japan
- Department of Anatomy and Developmental Biology, Graduate School of Medicine, Kyoto University, Kyoto, Japan
- Department of Neurodevelopmental Disorder Genetics, Institute of Brain Science, Nagoya City University Graduate School of Medical Sciences, Nagoya, Japan
- Laboratory for Neurogenetics, RIKEN Center for Brain Science, Saitama, Japan
- Department of Psychiatry, Fujita Health University School of Medicine, Toyoake, Japan
- Department of Neuropsychiatry, University of Toyama Graduate School of Medicine and Pharmaceutical Sciences, Toyama, Japan
- Research Center for Idling Brain Science, University of Toyama, Toyama, Japan
- Department of Neuropsychiatry, Okayama University Graduate School of Medicine, Dentistry and Pharmaceutical Sciences, Okayama, Japan
- Department of Psychiatry, Niigata University Graduate School of Medical and Dental Sciences, Niigata, Japan
- DOI
- 10.1038/s41398-020-01107-7
お問い合わせ先
研究について
名古屋大学医学部・医学系研究科
精神医学 教授 尾崎紀夫
TEL:052-744-2283 FAX:052-744-2293
E-mail:ozaki-n“AT”med.nagoya-u.ac.jp
広報担当
名古屋大学医学部・医学系研究科総務課総務係
TEL:052-744-2228 FAX:052-744-2785
E-mail:iga-sous“AT”adm.nagoya-u.ac.jp
AMED事業について
国立研究開発法人日本医療研究開発機構
疾患基礎研究事業部疾患基礎研究課
TEL:03-6870-2286 FAX:03-6870-2243
革新的技術による脳機能ネットワークの全容解明プロジェクト
E-mail:brain-m“AT”amed.go.jp
脳科学研究戦略推進プログラム
E-mail:brain-pro“AT”amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
掲載日 令和3年1月19日
最終更新日 令和3年1月19日


