幹細胞分裂タイプの違いが毛包の再生・老化を決定づけることを発見―毛髪再生を含む上皮の再生促進・抗老化に期待―
成果情報
国立大学法人東京医科歯科大学
国立大学法人東京大学医科学研究所
国立研究開発法人日本医療研究開発機構
ポイント
- 毛を生やす小器官である毛包において、器官の運命を決定する幹細胞分裂タイプが存在することをはじめて明らかにしました。
- 毛包幹細胞が発現するXVII型コラーゲンは、細胞極性蛋白として知られるaPKCλの発現を維持することによって再生型の幹細胞分裂を促進することを明らかにしました。
- 加齢によって毛包幹細胞におけるXVII型コラーゲンが減少すると、再生型からストレス応答性の非対称分裂へとスイッチし、幹細胞の枯渇による毛包の矮小化と脱毛を引き起こすことを明らかにしました。
- 上皮組織の老化機序の理解や抗老化戦略の開発への応用が期待できます。
東京医科歯科大学・難治疾患研究所・幹細胞医学分野の松村寛行助教と西村栄美教授(東京大学・医科学研究所教授兼任)らの研究グループは、横浜市立大学分子細胞生物学分野、フランス国立科学研究センターなどとの共同研究で、加齢に伴う脱毛の原因が幹細胞分裂にあることをつきとめました。この研究は、国立研究開発法人日本医療研究開発機構(AMED)『老化メカニズムの解明・制御プロジェクト』ならびに文部科学省科学研究費補助金(2622130、18H02637)の支援のもとでおこなわれたもので、その研究成果は、国際科学誌Nature Aging(ネイチャーエイジング)に、2021年2月11日午前11時(米国東部時間)にオンライン版で発表されました(URL:https://rdcu.be/ce818)。
研究の背景
わたくしたちのからだを構築する多くの組織や臓器は、加齢に伴いその構築や機能が衰え、再生能力も低下し、より小さく硬くなっていきます。近年、老化細胞の蓄積が加齢に伴う臓器の機能低下の原因として注目を集めています。一方で、組織幹細胞システムを形成する多くの組織や臓器は、加齢に伴い幹細胞の枯渇によって本来供給される機能細胞が減少して機能低下を引き起こすことも知られるようになりました。毛を生やす小型の器官である毛包はその典型例です。幹細胞はその自己複製と分化細胞の供給によって組織を維持しており、その分裂軸の違いに基づく対称分裂(均等分裂)と非対称分裂(不均等分裂)※1を行いますが、そのバランスが加齢によって崩れることがいくつかの系で報告されています。しかし、幹細胞の自己複製の実態はいまだ明らかではなく、器官の再生または老化を担う幹細胞の分裂タイプの存在や組織の再生や老化との関連については明らかにされていませんでした。
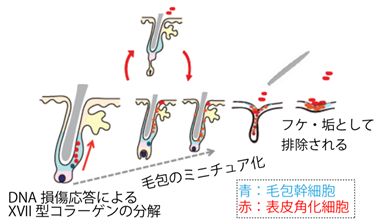
我々のこれまでの研究から、ヘミデスモソーム※2構成因子であるXVII型コラーゲン※3を発現する毛包幹細胞※4が、毛包の再生に必須であることを明らかにしていました(Cell Stem Cell 2009)。また、加齢に伴うDNA損傷や放射線などの環境ストレスに応じて、XVII型コラーゲンの分解を引き起こすことで、毛包幹細胞が自己複製を行ったり毛を生やす細胞を産生する代わりに、表皮角化細胞を生み出しフケ・垢として脱落させることにより、段階的に毛包のミニチュア化が進み、これによって薄毛や脱毛が引き起こされることを明らかにしてきました(松村ら Science 2016)(図1)。しかしながら器官の再生と老化を司る幹細胞分裂タイプの存在やその分子基盤については全く分かっていませんでした。
研究成果の概要
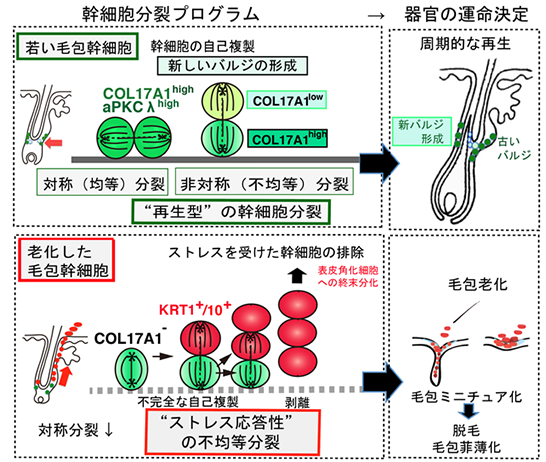
本研究チームは、まず、若いマウスにおいて毛包幹細胞の系譜解析と分裂軸の解析を組み合わせ、その分裂期とその後の幹細胞動態を解析しました。若い野生型マウスにおいては、毛包幹細胞が“再生型”の幹細胞分裂(典型的な対称(均等)分裂と幹細胞ニッチを倍加するための非対称(不均等)分裂)を引き起こすことによって、毛包幹細胞とそのニッチ※5(バルジ領域(膨隆部))が倍加していることが示されました(図2、上)。一方、加齢したマウスで、同様の解析を行ったところ、基底膜に対し垂直に分裂する際に、分化マーカーであるKRT1/10を発現する表皮角化細胞へと分化した細胞を生み出す“特殊な”不均等分裂(縦分裂)を引き起こしていることが分かりました(図2、下)。また、放射線などのゲノムストレスなどの存在下でも同様の幹細胞分裂が観察されました。加齢やストレスの存在下においても同様の幹細胞運命の転換が引き起こされることから、これを“ストレス応答性の不均等分裂”と名付けました(図2、下)。このタイプの非対称分裂は、ヘミデスモソーム※2構成因子のXVII型コラーゲンやインテグリンα6を欠損するマウスに加え、上皮の極性形成に関わる分子としても知られるaPKCλを安定的に発現化させ、“再生型”の幹細胞分裂を行うのに対し、加齢によるその発現減少は、“ストレス応答性の非対称分裂”を引き起こし、毛包幹細胞の枯渇を反復性に引き起こすため、基底膜との接着がさらに脆弱となり、幹細胞の枯渇が進むことが分かりました(図2、下)。また、ヒト毛包においても、マウスと同様にミニチュア化した毛包においてXVII型コラーゲンおよびaPKCλの発現低下が観察されたことから、ヒト毛包においても同様の機構が存在することを示唆しています。これらの結果から、XVII型コラーゲンやaPKCλを介した幹細胞分裂プログラムが、組織の再生と老化を制御していることが明らかになりました(図2)。
研究成果の意義
高齢化社会において老化のメカニズムの解明とその応用による健康長寿の実現化が期待されています。今回、上皮系の小器官である毛包において再生と老化を担う幹細胞分裂プログラムの存在が明らかとなり、その分子基盤の一端が解明されました。本研究成果は、幹細胞分裂プログラムによる器官の再生と老化の仕組みについて新しい視点を与えると同時に、脱毛症の治療法の開発やその他の上皮系臓器の加齢関連疾患の治療へと繋がることが期待できるものと考えられます。
用語解説
- ※1
- 細胞分裂軸の配向は、組織の構造や多様性や生み出しています。一つは、基底膜に対して水平に配向しながら細胞極性を持たずに分裂することで、均等に同じ状態の運命の幹細胞を生み出す対称(均等)分裂であり、もう一つは、基底膜に対して垂直に配向しながら細胞極性を持ちながら分裂することで、自己複製する幹細胞と分化細胞を生み出す非対称(不均等)分裂です(図3)。
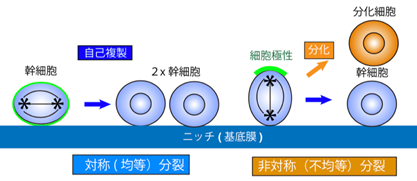
図3 対称分裂と非対称分裂による組織恒常性維持 - ※2
- ヘミデスモソームは、その構成因子である膜貫通型タンパク質であるXVII型コラーゲンやインテグリンα6を介して、上皮細胞を基底膜に接着させることで、細胞-マトリックス間結合に中心的役割を果たしています。
- ※3
- XVII型コラーゲンは、ヘミデスモソーム構成因子です。ヒトおよびマウスでのXVII型コラーゲンの先天性欠損は、脱毛、皮膚の脆弱性、萎縮などをきたす結合部型表皮水疱症の一亜型を引き起こします。
- ※4
- 毛包幹細胞は、毛包の再生を担う組織幹細胞で、バルジ領域(膨隆部)に存在しています。
- ※5
- ニッチとは、幹細胞にとって最適の微小環境、あるいは最適の微小環境を与える細胞を示します。
論文情報
- 掲載誌
- Nature aging
- 論文タイトル
- Distinct types of stem cell divisions determine organ regeneration and aging in hair follicles
研究者プロフィール
松村寛行(マツムラヒロユキ)Hiroyuki Matsumura
東京医科歯科大学 難治疾患研究所 幹細胞医学分野 助教
研究領域
幹細胞生物学、老化生物学、癌生物学など
西村栄美(ニシムラエミ)Emi K. Nishimura
東京医科歯科大学 難治疾患研究所 幹細胞医学分野 教授
東京大学 医科学研究所 老化再生生物学分野 教授
研究領域
幹細胞生物学、老化生物学、皮膚科学、癌生物学など
お問い合わせ先
報道に関すること
東京医科歯科大学 総務部総務秘書課広報係
〒113-8510 東京都文京区湯島1-5-45
TEL:03-5803-5011 FAX:03-5803-0272
E-mail:kouhou.adm“AT”tmd.ac.jp
AMED事業に関するお問い合わせ
日本医療研究開発機構(AMED)
疾患基礎研究事業部 疾患基礎研究課
TEL:03-6870-2286 FAX:03-6870-2243
老化メカニズムの解明・制御プロジェクト
E-mail:aging“AT”amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
関連リンク
掲載日 令和3年3月17日
最終更新日 令和3年3月17日


