成果情報 金属を持たない新たな炭酸脱水酵素を発見―生物が二酸化炭素を変換する多様な仕組み―
成果情報
筑波大学
高エネルギー加速器研究機構
日本医療研究開発機構
炭酸脱水酵素(Carbonic anhydrase; CA)は、バクテリアから真核生物まで様々な生物に存在し、二酸化炭素と重炭酸イオンを相互変換する反応の触媒として作用します。この反応は、呼吸や光合成、細胞のpH恒常性などに関わるもので、現在までに8つの異なる種類のCAが報告されています。これらは、タンパク質の配列や構造は異なるものの、全て、活性中心に亜鉛などの金属補因子(金属イオン)を含む金属酵素として知られていました。
本研究では、バクテリアや真核藻類に広く保存されている機能未知タンパク質COG4337が、金属イオンを持たない新規のCAであることを、生化学的解析とX線結晶構造解析により発見しました。これまでCAは、活性中心の金属イオンが水分子の活性化を行うと考えられてきましたが、COG4337タンパク質は、親水性と疎水性のアミノ酸で構成される小さな穴を持ち、その内部で水分子と二酸化炭素を反応させて重炭酸イオンの合成を行います。すなわち、従来知られているものとは異なるメカニズムを持ちます。金属イオンを必要としないCOG4337タンパク質は、陸から離れた海洋など金属の乏しい環境でも機能することができるため、そのような環境に生息する生物において進化したと推測されます。本研究成果は、「炭酸脱水酵素=金属酵素」という固定概念を覆し、CAの新たな多様性を示すものです。
研究の背景
炭酸脱水酵素(Carbonic anhydrase; CA)は、二酸化炭素(CO2)と水(H2O)から重炭酸イオン(HCO3-)と水素イオン(H+)に相互変換する反応を触媒する重要な酵素で、生物全般に存在しています。ヒトにおいては、赤血球内に豊富なCAが存在し、呼吸で作られる二酸化炭素の変換に関与しています。一方、植物や藻類では、光合成反応に必要な二酸化炭素の供給にCAが使用されています。CAは古くから研究され、現在までに8つの異なる種類のCAが報告されており、それぞれギリシャ文字のalpha(アルファ)からiota(イオタ)で分類されています。これらは、種類ごとにアミノ酸配列や立体構造が異なっており、それぞれ収斂進化注1)してきたと考えられていますが、共通して活性中心に金属補因子(通常は亜鉛イオン)を持っていることから、この金属イオンが酵素反応に必須であるとされてきました。
研究内容と成果
本研究では、藻類やバクテリアに広く見られるものの、機能が全く分かっていなかったタンパク質COG4337の解析を行い、これが、金属を含まない新規の炭酸脱水酵素であることを発見しました。
シアノバクテリア(Anabaena sp.)と真核藻類(Bigelowiella natans)のCOG4337遺伝子を用いてリコンビナントタンパク質注2)を作成し、生化学的解析を行ったところ、COG4337タンパク質が二酸化炭素を重炭酸イオンに変換する酵素活性を持つことを見いだしました。興味深いことに、この酵素活性は、金属イオンに非依存的でした。さらに、X線結晶構造解析注3)と部位特異的なアミノ酸置換解析注4)により、COG4337タンパク質の活性中心を特定し、そこに金属補因子が存在しないことを明らかにしました(参考図)。
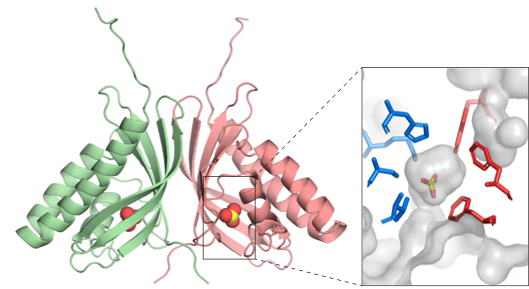
COG4337タンパク質は、部分配列や構造の類似性では、iotaクラスに分類されますが、金属イオンを含まない点で既存のものとは異なっていることから、新規変異型のiota-CAであると考えることができます。このような、金属補因子を必要としないCAの発見は、「炭酸脱水酵素=金属酵素」というこれまでの概念を覆し、CAの新たな多様性を示すものです。変異型のiota-CAは、地球上に広く生息する藻類が保持しており、効率的に光合成を行うための二酸化炭素濃縮機構注5)に関与していると考えられます。
また、異なる地域に生息するシアノバクテリア(Synechococcus)の炭酸脱水酵素を調べたところ、金属の乏しい外洋域に生息するSynechococcusは変異型のiota-CA(COG4337)を保持している一方、沿岸域に生息するSynechococcusは従来のiota-CAを持つことも分かりました。このことから、生息する環境に適応するために、金属補因子に依存しないタイプのCAが進化したと推測されます。
今後の展開
本研究成果により、炭酸脱水酵素の潜在的な多様性が示唆されたことから、まだまだ発見されていないCAが存在する可能性があります。昨今の地球温暖化を背景に、CAを用いて大気中の二酸化炭素を水和する応用研究も進められており、多様なCAの機能や特性を理解することが、それらの研究にもつながると期待されます。
用語解説
- 注1)収斂進化
- 進化・系統的に異なるものが、類似した形質を独立に獲得する現象。ここでは、系統的に異なる種類の炭酸脱水酵素が、活性中心に金属イオンを持つ形質を共有していることを指す。
- 注2)リコンビナントタンパク質
- 精製に必要なタグ配列などを付加した遺伝子を、大腸菌などに導入して発現させる組み換えタンパク質。
- 注3)X線結晶構造解析
- 精製したタンパク質を用いて作製した結晶にX線を照射して、得られた回折パターンを基に立体構造を決定する手法。原子レベルでのタンパク質の構造決定に用いられる。
- 注4)アミノ酸置換解析
- 遺伝子の塩基配列を操作することで、合成されるリコンビナントタンパク質のアミノ酸配列に変化を加え、機能に重要なアミノ酸などを特定する手法。
- 注5)二酸化炭素濃縮機構
- 水中など二酸化炭素が乏しい環境に生息する光合成藻類が、CO2とHCO3-の相互変換により、効率的に二酸化炭素の濃縮と拡散防止を行う仕組み。
研究資金
本研究は、科学研究費補助金、日本医療研究開発機構(AMED)創薬等ライフサイエンス研究支援基盤事業(BINDS)JP20am0101071の研究プロジェクトの一環として実施されました。
掲載論文
- 題名
- Characterization of a novel type of carbonic anhydrase that acts without metal cofactors.
(金属補因子を含まない新規の炭酸脱水酵素の特性解明) - 著者名
- Yoshihisa Hirakawa, Miki Senda, Kodai Fukuda, HongYang Yu, Masaki Ishida, Masafumi Taira, Kazushi Kinbara, Toshiya Senda
- 掲載誌
- BMC Biology
- 掲載日
- 2021年5月18日
- DOI
- 10.1186/s12915-021-01039-8
プレスリリース
筑波大学
URL:https://www.tsukuba.ac.jp/journal/biology-environment/20210525140000.html
高エネルギー加速器研究機構
URL:https://www.kek.jp/wp-content/uploads/2021/05/PR20210525.pdf
お問合わせ先
研究に関すること
平川 泰久(ひらかわ よしひさ)
筑波大学生命環境系 助教
TEL:029-853-5600(内8794)
E-mail:hirakawa.yoshi.fp“AT”u.tsukuba.ac.jp
筑波大学 研究者総覧
千田 俊哉(せんだ としや)
高エネルギー加速器研究機構物質構造科学研究所 教授
構造生物学研究センター
取材・報道に関すること
筑波大学広報室
TEL:029-853-2040
E-mail:kohositu“AT”un.tsukuba.ac.jp
高エネルギー加速器研究機構広報室
TEL:029-879-6047
E-mail:press“AT”kek.jp
AMED事業に関すること
日本医療研究開発機構(AMED)創薬事業部 医薬品研究開発課
創薬等ライフサイエンス研究支援基盤事業(BINDS)
TEL:03-6870-2219
E-mail:20-DDLSG-16“AT”amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
関連リンク
掲載日 令和3年6月21日
最終更新日 令和3年6月21日


