成果情報 酸素の発生を伴わない光合成の謎を解明―光合成細菌の高効率なエネルギー変換を司る複合体の可視化により、太陽光利用などに役立つことが期待―
成果情報
三重大学
日本医療研究開発機構
- 光合成の際に酸素を発生しない「光合成細菌」の光捕集複合体を立体的に可視化することに成功
- バイオテクノロジーで利用される光合成細菌の光捕集メカニズムは非常に高効率で、太陽光エネルギーの多様かつ効率的な利用のヒントになると期待
- 光合成細菌は農業や環境分野での活用が進められてきたが、特にそのエネルギー変換の鍵を握るロドキノンは、駆虫薬ターゲットとしても注目されており、その結合状態を可視化できたことで、安全な駆虫薬の開発に貢献
- Ca2+(カルシウムイオン)がなくても光捕集複合体を安定化できる相互作用やキノンの流入出経路モデルも初めて解明
概要
三重大学医学系研究科の谷一寿特任教授、溝口明教授、茨城大学の大友征宇教授、沖縄科学技術大学院大学のBruno Humbel博士らは、光合成細菌の光合成モデルとして研究が進んでいる細菌の一種Rhodospirillum rubrum(ロドスピリラム・ルブルム)(R. rubrum)の「膜タンパク質コア光捕集複合体*1」をクライオ電子顕微鏡*2により立体的に可視化することに成功しました。光捕集複合体は、光合成細菌が光エネルギーを集め、電子変換し、伝達することを可能にしている膜たんぱく質で、特に、今回は、駆虫剤ターゲット候補としても注目されているロドキノン*3が膜タンパク質の脂質内で結合した状態で可視化できた世界でも数少ない例となります。
また、光捕集複合体の流入出経路を示唆することにより、光の捕集からキノンを介した電子伝達の経路を明らかにすることもできました。さらに、これまでに構造が解明されていた複合体は、Ca2+のある環境下で安定化していましたが、本複合体はCa2+がなくても安定する相互作用を備えていることが初めてわかりました。
三重大学、茨城大学、沖縄科学技術大学院大学、中国科学院植物研究所、神戸大学、南イリノイ大学の共同研究によるこの成果は、生化学分野の世界的な学術誌「Biochemistry」にオンライン掲載されました。
背景
光合成を行う際、植物やシアノバクテリアでは酸素を発生しますが、光合成細菌は酸素を発生せず、非常に高い効率で太陽の光を電子エネルギーへ変換できるように進化してきました。種ごとの様々な棲息環境に適応し、海水や温泉に含まれるCa2+を利用した安定化や、酸素の存在程度に応じて電子伝達で使用するキノン類に差がみられるなどバラエティーに富んでいます。どの光合成細菌も太陽の光エネルギーを利用するという点では同じなのですが、環境に応じて光捕集のメカニズムが最適な装置になるようそれぞれが進化のバイアスを受けています。
また、光合成細菌の光合成は、酸素発生型の光合成と類似の部分もありますが、酸素非発生型として効率を重視した独自の進化過程を遂げたことがわかっています。一方で、独自に発展した立体構造と機能との相関性は不明な部分も多く、20年近く前に電子顕微鏡を用いた投影像で注目されていたにも関わらず、長らく三次元構造が決定されず謎とされてきました。
光合成細菌は、田んぼや温泉など身近なところに生息しています。農作物にとっての有害物質を栄養とし、有益な栄養分を排出する種もおり、化学物質に頼らない農業への活用も進められてきました。また、非常に高いエネルギー変換効率を持つことが知られており、酸素を発生しない光合成のメカニズムの解明は、様々な分野から期待が寄せられています。
研究内容
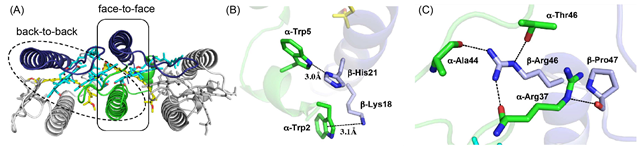
Ca2+によって安定化される別種のコア光捕集複合体については、当研究グループを含め複数のグループから報告されており、その安定化のメカニズムが明らかになってきました。しかしCa2+への依存性がない複合体のメカニズムについては未解明で、今回の研究では、クライオ電子顕微鏡を用いた単粒子解析法によりようやく明らかにすることができました(図1)。R. rubrumの構造はほぼディスク様であることから、各粒子画像と三次元構造との配向関係の決定が困難なため分解能が4.0Å分解能程度で止まっていましたが、解析手法の改善により2.76Å分解能に向上させることができ、バクテリオクロロフィル等を可視化できるようになりました(図2)。さらに、構造既知ホモログとの比較により、新しい相互作用パターンによりCa2+非存在下で安定化されることが明らかになりました(図3)。
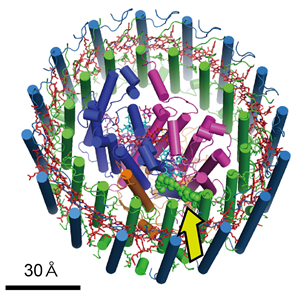
矢印で指した部分がロドキノン(緑球状モデル)
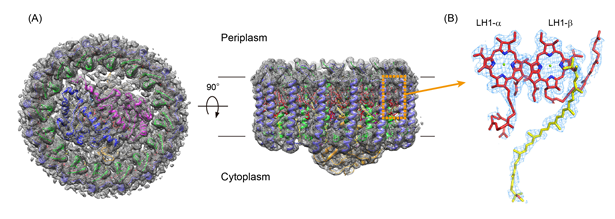
また、ロドキノンが複合体に含まれていることは解明されていましたが、結合位置を含めて可視化することで、嫌気性(酸素を必要としない)条件下での光合成の効率向上に一役買っていることもわかりました。約20年前、このタンパク質複合体が電子顕微鏡により2次元の投影像で示されましたが、今回、詳細な三次元構造を明らかにし、キノンの流入出経路のモデルも含めて提示することができました。
今後の展望
酸素を発生しない光合成細菌が行う光合成は、進化的に原始的なものですが、高い効率性を実現しています。本研究で可視化したこのメカニズムは、太陽光エネルギーの人工的利用の発展に貢献することが期待できます。また、明らかにしたメカニズムを基に、すでに生物工学でも利用されているR. rubrumの効率向上の研究を進め、地球環境保全・SDGsの達成にも寄与していきたいと考えています。
用語解説
- *1 コア光捕集複合体(LH1-RC)
- 光エネルギーをアンテナタンパク質(LH1)で効率的に捕集して、反応中心(RC)へ伝え、光から電子への変換を行い、キノン類を介して電子を伝達する複合体膜タンパク質。
- *2 クライオ電子顕微鏡
- 生体の高分子構造を立体的に解析できる手法の一種。2017年ノーベル化学賞。
- *3 ロドキノン
- 嫌気的呼吸(酸素を必要としない呼吸)において、エネルギー変換のための電子伝達体として機能するもの。光合成の際に酸素を発生しない光合成細菌などに見られる。哺乳類のミトコンドリアではユビキノンが使われるが、回虫などの嫌気的呼吸鎖ではロドキノンが使われるため駆虫薬ターゲットとなる。
論文情報
- 掲載誌
- Biochemistry, vol. 60, p. 2483-2491
- 掲載日
- 2021年7月29日(On line版)
(https://doi.org/10.1021/acs.biochem.1c00360) - 論文タイトル
- Cryo-EM Structure of the Photosynthetic LH1-RC Complex from Rhodospirillum rubrum
- 著者
- Kazutoshi Tani, Ryo Kanno, Xuan-Cheng Li, Malgorzata Hall, Long-Jiang Yu, Yukihiro Kimura, Michael T. Madigan, Akira Mizoguchi, Bruno M. Humbel, and Zheng-Yu Wang-Otomo
研究支援
本研究は、国立研究開発法人日本医療研究開発機構(AMED)創薬等ライフサイエンス研究支援基盤事業(BINDS)JP21am0101118, JP21am0101116等の支援を受けて実施されました。
お問い合わせ先
本件に関するお問合せ
三重大学医学研究科 谷 一寿 特任教授
TEL:059-231-5687
E-mail:ktani“AT”doc,medic,mie-u.ac.jp
茨城大学理工学研究科 大友 征宇 教授
E-mail:seiu.otomo.sci“AT”vc.ibaraki.ac.jp
AMED事業に関するお問合せ
日本医療研究開発機構 創薬事業部 医薬品研究開発課
創薬等ライフサイエンス研究支援基盤事業(BINDS)
TEL:03-6870-2219
E-mail:20-DDLSG-16“AT”amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
関連リンク
掲載日 令和3年8月27日
最終更新日 令和3年8月27日


