成果情報 実患者における同種造血幹細胞移植後のサイトメガロウイルス特異的細胞傷害性T細胞の特徴―ウイルス免疫再構築の動態解明と新規免疫療法開発に向けて―
成果情報
自治医科大学
日本医療研究開発機構
概要
自治医科大学医学部総合医学1(血液科)の仲宗根秀樹講師らは、同種造血幹細胞移植後の実際の患者検体を用いて、移植後合併症として非常に重要なサイトメガロウイルスの再活性化に着目し、サイトメガロウイルス特異的細胞傷害性T細胞のクローン解析と遺伝子発現プロファイル解析により、サイトメガロウイルス再活性化パターン毎の特徴を明らかにしました。
実臨床で実施される造血幹細胞移植を、抗ウイルス免疫再構築のhuman modelと捉えることで、再活性化が問題となるB型肝炎ウイルスやリンパ増殖症をきたすEBウイルスなどの研究に広く応用されうるトランスレーショナルリサーチに発展する可能性があり、今後の新しい治療法開発につながることが期待されます。
本研究は、日本医療研究開発機構(AMED)感染症研究革新イニシアティブ(J-PRIDE)(研究開発代表者 仲宗根秀樹)の支援を受け行ったものです。
本研究の成果は、科学雑誌『Communications Biology』(日本時間2021年10月11日18時;DOI:10.1038/s42003-021-02709-7)に掲載されました。
研究背景
昨今、新興感染症、再興感染症、日和見感染症の中で、様々なウイルス感染症が世間をにぎわせております。悪性腫瘍に対する抗がん剤治療やリウマチなど自己免疫疾患に対する免疫抑制治療によりもたらされる免疫不全状態では、一般的にはありふれたウイルスであっても命に係わる合併症を引き起こすことがあります。特に、血液悪性腫瘍(白血病や悪性リンパ腫など)の根治治療の一つである同種造血幹細胞移植[1]は、大量抗がん剤・放射線療法に加え強度の免疫抑制が必要であり、腫瘍だけでなく感染症を含めた合併症との戦いでもあります。特にウイルス感染管理は、生命予後だけでなく生活の質(QOL)の改善にもつながる重要なテーマの一つであり、ウイルスに対する体内での免疫再構築の理解が急務とされています。移植後ウイルス感染症の中でも、特にサイトメガロウイルス[2]の再活性化は、重度の肺炎、腸炎、肝炎、網膜炎などにつながる危険があり、実際に日本造血・免疫細胞療法学会の合併症ワーキンググループからの報告でも、移植後のサイトメガロウイルス再活性化と非再発死亡の増加が相関することが知られています(Akahoshi, Nakasone et al. Clin Infect Dis. 2021)。
長期的なサイトメガロウイルス感染のコントロールには、薬剤による治療だけでなく、患者体内での免疫による制御が必要とされますが、サイトメガロウイルスの再活性化を反復してしまう症例は少なくありません。治療経過の中でサイトメガロウイルスを制御する免疫がどのように構築され機能を維持されていくのか不明な点も多いのが現状です。そこで本研究グループは、実際に移植を受けた患者検体を用いて、ウイルス制御において重要なT細胞の特徴を再活性化のパターンに応じて明らかにすることに挑戦しました。
研究手法と成果
本研究では、HLA[3](ヒト白血球抗原)の一種であるHLA-A24を持つドナーから同種造血幹細胞移植を受けた症例の血液検体を用いて、移植後経過中にサイトメガロウイルスの再活性化を起こさなかった群(no-CMV群)、一度再活性化を起こすもその後治療により安定した群(one-episode群)、再活性化を反復した群(repeated群)の3群における比較を目的として、HLA-A24拘束性のサイトメガロウイルス特異的細胞傷害性T細胞を患者検体から直接分離し、主に下記の解析を実施しました。
T細胞受容体の超可変領域のアミノ酸配列の同定と比較
次世代シークセンサーを用いて、細胞傷害性T細胞のT細胞受容体β鎖の超可変領域[4](TCRb-CDR3)を同定したところ、そのアミノ酸長は15個を中心として分布していることがわかりました(図1a)。そこで、各患者内で5%以上を占めるmajor cloneに絞り、再活性化のパターンで比較したところ、repeated群→one-episode群→no-CMV群と順にアミノ酸長が長いTCR-CDR3を多くとることがわかりました(図1b)。次に、同様にmajor cloneに絞りTCRb-CDR3に選択されたアミノ酸を比較してみますと、15個のアミノ酸長のTCRb-CDR3では、“GGG” motifがno-CMV群で多く認められるのに対し、repeated群ではほとんど認められないことがわかりました(図1c)。
また、no-CMV群で多く認められた17個のアミノ酸長のTCRb-CDR3では、”G#GG” motifを取ることもわかりました(図1d)。
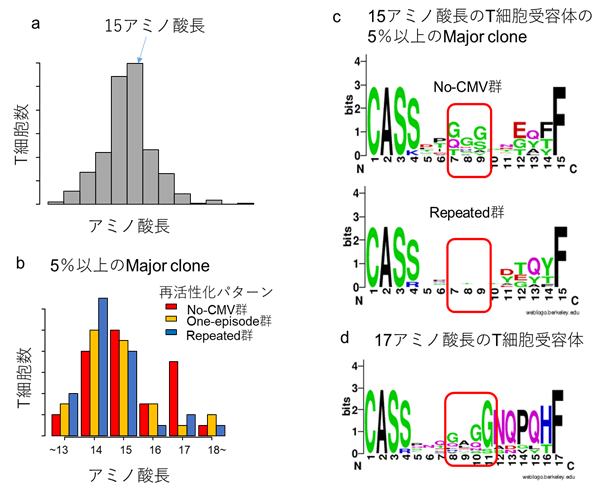
- 2万個近いT細胞を解析し約350個のT細胞クローンを同定したところ、同定されたT細胞クローンのTCRb-CDR3のアミノ酸配列の長さは15個のアミノ酸を中心として分布した。
- 各患者内で5%以上を占めるmajor cloneに着目し、サイトメガロウイルス再活性化パターンごとのTCRb-CDR3の長さを比較したところ、移植後再活性化がない群(no-CMV群)では、再活性化を反復した群(Repeated群)と比較してアミノ酸配列が長いものが多い。
- 各患者内で5%以上を占めるmajor cloneの中でも、TCRb-CDR3に15個のアミノ酸をもつT細胞クローンに着目し、サイトメガロウイルス再活性化パターンでそのアミノ酸配列を比較すると、超可変領域に該当する7-9番目の位置に、”GGG”というアミノ酸モチーフをno-CMV群では取りやすいが、Repeated群ではそのようなモチーフを認めなかった。
- No-CMV群で多く認められた、TCRb-CDR に17個のアミノ酸をもつT細胞クローンのアミノ酸配列に着目すると、”G#GG”というアミノ酸モチーフを取りやすいことがわかった。
サイトメガロウイルス抗原ペプチドとT細胞受容体の予測結合親和性の比較
一般的に、標的細胞のHLA上で提示された抗原ペプチドと攻撃細胞であるT細胞受容体との間の結合親和性が高いほど、T細胞の活性化と細胞傷害性の強度が強いことが知られています。そこで、上記の結果をもとに、「”GGG” や“G#GG” motifをもつT細胞はサイトメガロウイルス抗原ペプチドと結合しやすいのではないか?」もしくは「no-CMV群では、一律に結合力が高いT細胞が多いのではないか?」の二つの考えられうる仮説を検証するために、機械学習を用いたERGOシステム(Springer et al. Front Immunol 2020)で予測されるT細胞受容体のサイトメガロウイルス抗原ペプチドとの結合親和性の比較を行いました。各患者内で5%以上を占めるmajor cloneに絞り解析したところ、有意に”GGG” や“G#GG” motifをもつT細胞の予測結合親和性が高いことが判明しました(図2a)。一方で、repeated群だからと言って結合親和性の高いT細胞が検出されないわけではないことも明らかになりました(図2b)。しかし、実際に検出された各T細胞クローンのカウントで結合親和性の重みづけを行ったところ、有意にno-CMV群で高いことがわかりました(図2c)。このことは、サイトメガロウイルス再活性化の制御には、単に結合親和性の高いT細胞が存在するだけでは不十分で、効率的なT細胞の増殖が必要であることを示しています。
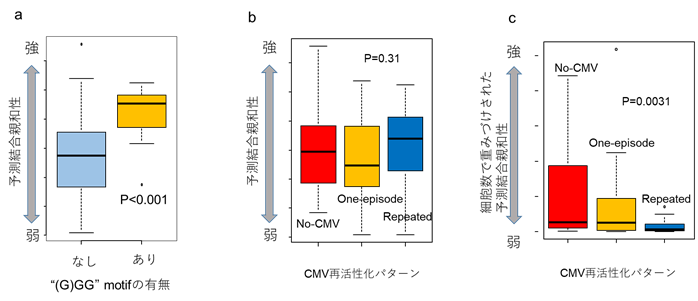
- T細胞受容体の超可変領域(TCRb-CDR3)に”GGG”もしくは”G#GG”モチーフがある場合、サイトメガロウイルスのpp65抗原ペプチド(QYDPVAALF)との予測結合親和性が有意に高い。
- 再活性化パターンで分けた各群において同定されたT細胞クローンとサイトメガロウイルスのpp65抗原ペプチドとの予測結合親和性に群間差は認められない(Kruskal-Wallis検定)。
- T細胞受容体とサイトメガロウイルスのpp65抗原ペプチドの予測結合親和性をさらに検出されたクローンカウントで重みづけを行うと、移植後再活性化がない群(no-CMV群)で高く、次に、一度のみの再活性化群(one-episode群)、そして、再活性化を反復した群(repeated群)と順に低くなっていく傾向が明らかになった(傾向性の検定:Jonckheere-Terpstra test)。
サイトメガロウイルス特異的細胞傷害性T細胞の遺伝子発現プロファイルの比較
上記2つの解析では、アミノ酸配列といった構造的な相違に着目しましたが、機能的な側面を評価するために、RNAシークエンスを用いて患者間のサイトメガロウイルス特異的細胞傷害性T細胞の遺伝子発現プロファイルの比較を行いました。
理論的には、ドナーがサイトメガロウイルス既感染であれば、ドナー体内ですでに構築されていたサイトメガロウイルス特異的T細胞が移植後患者体内へ移行すると考えられます。一方で、ドナーがサイトメガロウイルス未感染であれば、移植後に機能するドナー由来のT細胞は、患者体内で初めてサイトメガロウイルスに感作された後に、サイトメガロウイルスに対する免疫が新たに構築されると考えられます。
そこで、ドナーがサイトメガロウイルス既感染か未感染かで分けた上で、再活性化のパターンで比較したところ、サイトメガロウイルス既感染ドナーからの移植では、no-CMV群では感染細胞を排除する際に必要なTNFなどの炎症性サイトカインなどが上昇し、T細胞免疫の活性化にかかわる遺伝子が上昇していることがわかりました(図3a)。また、サイトメガロウイルス未感染ドナーからの移植に着目すると、repeated群ではCCR2やIL7Rの発現が上昇し、no-CMV群では逆にその遺伝子発現が抑えられていることが示され、repeated群では効率的なT細胞の活性化や増殖が抑えられている可能性が示唆されました(図3b)。興味深いことに、最近免疫チェックポイント分子として報告のあるLILRB1などがrepeated群で上昇していることもわかりました。
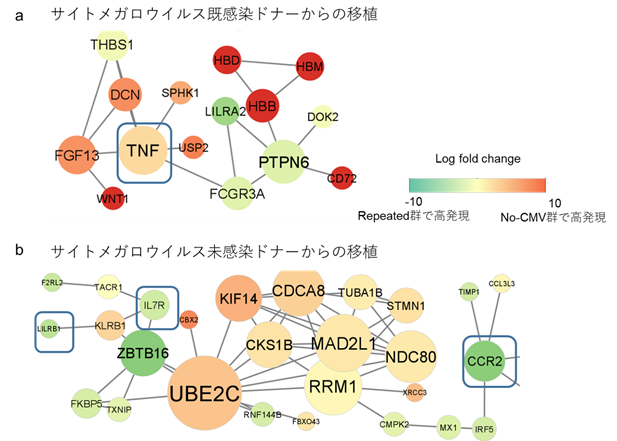
- サイトメガロウイルス既感染ドナーからの移植に着目。
再活性化を反復した群(Repeated群)と比較し、再活性化がない群(no-CMV群)では、ウイルス感染細胞を排除する際に必要なTNFなどの炎症再サイトカインが高発現している(明るい色ほどno-CMV群で高発現、緑色ほどrepeated群で高発現)。T細胞免疫の活性化や増殖にかかわる遺伝子がno-CMV群では上昇している。 - サイトメガロウイルス未感染ドナーからの移植に着目。
Repeated群では、CCR2やIL7Rといった、T細胞の活性化に伴い発現が低下する分子が高発現している(明るい色ほどno-CMV群で高発現、緑色ほどrepeated群で高発現)。また、LILRB1などの免疫チェックポイント分子がrepeated群で高発現している。repeated群では効率的なT細胞の活性化や増殖が抑えられている可能性が示唆される。
研究成果の意義と今後の期待
- サイトメガロウイルス特異的細胞傷害性T細胞は、移植後のサイトメガロウイルス再活性化パターンに応じて、T細胞受容体の超可変領域のアミノ酸長やアミノ酸モチーフに相違があることが示され、アミノ酸配列に応じて、各T細胞クローンにおけるウイルス抗原との予測結合親和性にも特徴があることが明らかとなりました。サイトメガロウイルス再活性化をきたさなかった症例の中で、さらにウイルス抗原との結合親和性が高いクローンを同定し人工的に増幅、もしくは同一のT細胞受容体を遺伝子導入したT細胞を作成する事で、難治例への細胞免疫療法につながる可能性があります。
- 再活性化パターンによるサイトメガロウイルス特異的細胞傷害性T細胞の遺伝子発現プロファイルの解析より、再活性化を反復した症例における免疫チェックポイント分子の高発現などの知見が得られ、これら細胞表面受容体を標的とした薬剤を開発することで、制御力の強いサイトメガロウイルス特異的細胞傷害性T細胞を効率的に患者体内で増幅させる治療法につながる可能性があります。
- 実臨床で実施される造血幹細胞移植を、抗ウイルス免疫再構築のhuman modelと捉えることで、その他のウイルス感染症研究だけでなく腫瘍免疫などに広くに応用できるトランスレーショナルリサーチに発展する可能性があり、今後の新しい治療法開発につながることが期待されます。
論文情報
- タイトル
- Features of repertoire diversity and gene expression in human cytotoxic T cells following allogeneic hematopoietic cell transplantation
- 著者名
- Hideki Nakasone, Machiko Kusuda, Kiriko Terasako-Saito, Koji Kawamura, Yu Akahoshi, Masakatsu Kawamura, Junko Takeshita, Shunto Kawamura, Nozomu Yoshino, Kazuki Yoshimura, Yukiko Misaki, Ayumi Gomyo, Kazuaki Kameda, Masaharu Tamaki, Aki Tanihara, Shun-ichi Kimura, Shinichi Kako, and Yoshinobu Kanda
- 雑誌
- Communications Biology
- DOI
- 10.1038/s42003-021-02709-7
補足説明
- [1]同種造血幹細胞移植
- 通常の抗がん剤治療では根治が難しい方を対象に、完治を目指して行う治療法の一つで、自分以外のヒト(ドナー)から造血幹細胞をもらい移植する治療法が同種造血幹細胞移植という。年々移植数は増加しており、現在では年間3500件以上の同種造血幹細胞移植が実施されている。大量の抗がん剤や全身への放射線治療を実施し、患者体内の腫瘍細胞を減少させたあと、そのままでは自己造血回復が期待できないため、ドナーからの正常造血細胞を移植する治療法。同種造血幹細胞移植では、ドナーのリンパ球が腫瘍細胞を免疫学的に攻撃する移植片対白血病効果も期待できることがある。ただし、ドナー細胞をまず生着させる必要があること、生着後はドナー由来の細胞にとって患者組織は異物であり、攻撃をして移植片対宿主病という病態になってしまう可能性があることから、長期にわたる免疫抑制が必要であり、本研究のサイトメガロウイルスを筆頭に様々な感染症などのリスクも高くなる。詳細は、一般的な参考サイト:国立がん研究センター がん情報サービスなどを参照されたい。
- [2]サイトメガロウイルス
- ヘルペスウイルス科βヘルペスウイルス亜科に属するウイルス。最近の我が国の抗体保有率は約7割程度で多くの人が既感染となっている。通常、幼小児期に不顕性に感染し、潜伏感染でヒト体内に存在し続ける。成人となり初感染した場合は伝染性単核球症の原因となり、妊婦が初感染した場合、胎児に重篤な影響を与え先天性サイトメガロウイルス感染症の原因ともなる。免疫抑制状態になると再活性化をおこし、同種造血幹細胞移植では、おおよそ6割の症例で再活性化が起こる。一旦、同種造血幹細胞移植患者でサイトメガロ感染症を発症すると発熱、間質性肺炎、腸炎、肝炎、網膜炎、脳炎といった種々の病態を引き起こし治療に難渋することも、命に係わる合併症を引き起こすこともある。ウイルスに関する詳細は、一般的な参考サイト:国立感染症研究所など、また同種造血幹細胞移植後のサイトメガロウイルス感染管理については、日本造血・免疫細胞療法学会ガイドラインなどを参照されたい。
- [3]HLA(human leukocyte antigen)
- かつては白血球の血液型として発見されたが、一部例外を除いてほぼすべての細胞に分布しており、自己と非自己を識別するための組織適合性抗原として働く免疫分子である。同種造血幹細胞移植では、拒絶や移植片対宿主病をできるだけ避ける観点から、ドナーと患者のHLAが一致することが望ましい。
HLAは、クラスIとクラスIIに分かれるが、細胞傷害性T細胞が認識するHLAはクラスIに属する。今回対象としたHLA24もクラスIに属し、日本人では約4割近くがHLA-A24を有している。一方、免疫を調整するヘルパーT細胞はクラスIIのHLAを認識する。詳細は一般的な参考サイト:HLA研究所などを参照されたい。 - [4]細胞傷害性T細胞のT細胞受容体の超可変領域
- 細胞傷害性T細胞は、宿主(ヒト)にとって異物となるもの(ウイルス感染細胞や腫瘍)などを認識して破壊するリンパ球の1種で、感染免疫にとって重要な役割を持つ。この細胞傷害性T細胞は、細胞膜上に発現しているT細胞受容体という個々のT細胞に特異的な抗原受容体分子を介して、標的細胞上のHLAに提示された抗原を異物として認識する。この抗原は、ウイルス等のタンパク質の部分構造(約10アミノ酸からなるペプチド)から成り、本研究ではサイトメガロウイルスが再活性化する際に検出されるpp65という抗原に対するT細胞を解析した。抗原が同一でも、HLAが異なると提示されやすいタンパク質の部分構造が異なるため、本研究では、日本人で多いHLA-A24に着目している。
様々な抗原に対応するためT細胞受容体の抗原結合部位は多様性を獲得しており、相補性決定領域(complementarity determining region, CDR)とよばれる。特に超可変領域とされるCDR3はV領域、D領域、J領域の遺伝子再構成により生じ、標的細胞上のHLAに提示された抗原ペプチドと接触する部分と考えられている。このためT細胞受容体の超可変領域を同定することは、個々のT細胞クローンを同定することと同義であると同時に、抗原ペプチドとの結合親和性の解析にも重要なものである。
研究者プロフィール
自治医科大学医学部 総合医学1(血液科)
講師 仲宗根秀樹(なかそね ひでき)
自治医科大学医学部 総合医学1(血液科)
教授 神田善伸(かんだ よしのぶ)
お問い合わせ先
研究に関するお問い合わせ先
自治医科大学医学部 総合医学1(血液科)
講師 仲宗根秀樹(なかそね ひでき)
〒330-8503 埼玉県さいたま市大宮区天沼町1-847
TEL:048-647-2111
E-mail:nakasone-tky“AT”umin.ac.jp
自治医科大学付属さいたま医療センター
報道・取材に関するお問い合わせ先
自治医科大学 大学事務部 研究支援課
〒329-0498 栃木県下野市薬師寺3311-1
TEL:0285-58-7550 FAX:0285-40-8303
E-mail:shien“AT”jichi.ac.jp
自治医科大学附属さいたま医療センター 総務課
〒330-8503 埼玉県さいたま市大宮区天沼町1-847
TEL:048-647-2111
E-mail:o-soumu”AT”omiya.jichi.ac.jp
AMED事業に関するお問い合わせ先
日本医療研究開発機構(AMED)
疾患基礎研究事業部 疾患基礎研究課
E-mail:jprogram“AT”amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
関連リンク
掲載日 令和3年11月2日
最終更新日 令和3年11月2日


