成果情報 筋ジストロフィーのゲノム編集治療を目指したLNP-mRNA輸送システムの開発
成果情報
京都大学iPS細胞研究所(CiRA)
タケダ-CiRA 共同研究プログラム(T-CiRA)
日本医療研究開発機構(AMED)
発表のポイント
- デュシェンヌ型筋ジストロフィー注1)のゲノム編集治療を行うには、全身の骨格筋組織全体にゲノム編集酵素を行き渡らせる方法の開発が課題だった。
- 複数回投与可能な脂質ナノ粒子(LNP)注2)を用いて、ゲノム編集酵素を骨格筋に運搬する方法を確立した。
- 本方法により、筋ジストロフィーモデルマウスの複数の骨格筋で同時にゲノム編集を行うことに成功した。
概要
見城江利也 主任研究員、穂積裕幸主任研究員、犬飼直人リサーチマネージャー(武田薬品工業株式会社、リサーチ T-CiRAディスカバリー)、堀田秋津 講師(京都大学CiRA、T-CiRA共同研究プログラム)らの研究グループは、ゲノム編集治療に利用可能なLNP輸送システムを開発し、筋ジストロフィーモデルマウスにゲノム編集治療を行うことに成功しました。
ゲノム編集治療はデュシェンヌ型筋ジストロフィーの治療法として期待されています。しかしゲノム編集を行う酵素であるCRISPR-Cas9注3)を生体内の骨格筋組織で広く働かせることが困難であり、薬剤運搬システムの開発が重要な課題でした。一般的にはアデノ随伴ウイルス(AAV)注4)べクターを用いた遺伝子導入法が使われてきましたが、中和抗体注5)ができてしまうために繰り返し遺伝子導入を行うことができません。 この問題を回避するために、研究グループはLNPに注目しました。新規脂質を用いて、製剤方法を最適化することで、筋肉組織へ効率よくCas9 mRNAを導入できるLNPを開発することができました。このLNPを使うと、ゲノム編集に必要なCas9 mRNAとガイドRNAを、筋肉内注射の繰り返しや灌流注6)によって、マウス骨格筋に広く行き渡らせたりすることができました。繰り返し投与することができる今回のLNPシステムは、骨格筋疾患の治療に使用する新しい薬剤運搬システムとしての利用が期待できます。
この研究成果は2021年12月8日に「Nature Communications」で公開されました。
研究の背景
デュシェンヌ型筋ジストロフィーは、筋肉で働くジストロフィンタンパク質が欠損することによって発症する、進行性の重篤な筋疾患難病です。患者さんはジストロフィン遺伝子の一部に変異が起こることが原因で、ジストロフィンタンパク質がうまく作れない状態になっているため、ジストロフィンタンパク質を作れるようにする(回復する)ためのゲノム編集治療が期待されています。これまでにCiRAの堀田講師らのグループでは、デュシェンヌ型筋ジストロフィーの患者さんから樹立したiPS細胞を利用して、ゲノム編集治療を目指した研究を進めて来ました。(「iPS細胞を使った遺伝子修復に成功~デュシェンヌ型筋ジストロフィーの変異遺伝子を修復~」CiRA ニュース 2014年11月27日)
患者さんの体内でゲノム編集を行うためには、ゲノム編集を行う酵素であるCRISPR-Cas9を細胞内に送り届けるシステムが必要となります。これまで、AAVベクターがよく用いられてきました(AAV-CRISPR)が、この方法では中和抗体ができてしまうため、繰り返しゲノム編集を行うことができず、デュシェンヌ型筋ジストロフィーにおいて症状がみられるような、全身の広範囲の骨格筋にゲノム編集を行うことは困難でした。
そこで堀田講師らは、T-CiRA共同研究プログラムにおいてLNPに着目し、デュシェンヌ型筋ジストロフィーの治療に必要なCRISPR-Cas9を広範囲の筋肉組織に送り届ける方法の開発を試みました。
研究結果
mRNAを骨格筋に効率的に送達できるLNPのスクリーニング
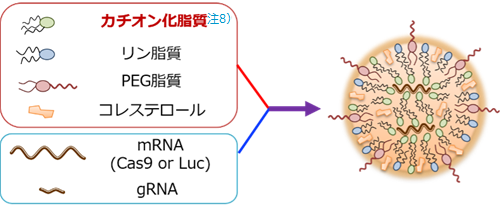
はじめにルシフェラーゼ注7)のmRNAを用いて、マウス骨格筋にmRNAを送達できるLNP組成を探索しました(図1)。ここで見出したLNPに、ゲノム編集を行うにあたって必要なCas9 mRNAとガイドRNAを搭載したところ(LNP-CRISPR)、骨格筋で効率よくゲノム編集が起こることを確認しました。
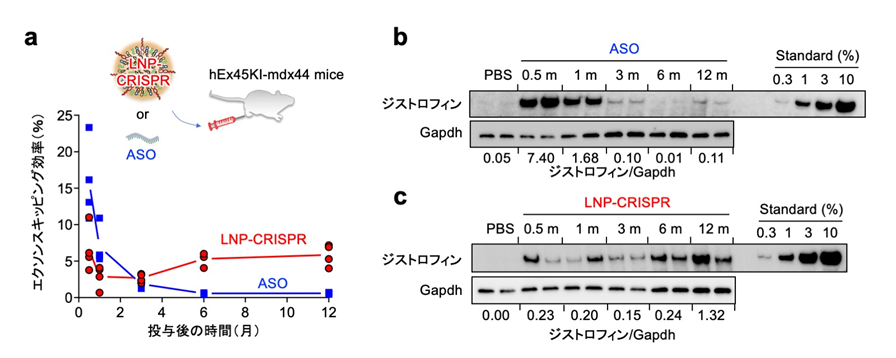
LNP-CRISPRを一回投与することで、ジストロフィンタンパク質の回復効果が一年に渡って継続する
患者さん由来iPS細胞を用いて最適化した、ヒト遺伝子配列を認識するガイドRNAをマウスで検討するために、マウスジストロフィン遺伝子の一部分をヒト遺伝子配列に置き換えた、筋ジストロフィーモデルマウス(hEx45KI-mdx44)を準備しました。このマウス骨格筋に、ジストロフィン遺伝子のmRNAに作用する核酸医薬(ASO:antisense oligo)注9)を一回投与した場合、ジストロフィンタンパク質の回復効果は一ヶ月程度しか持続しませんでした。一方、LNP-CRISPRの場合、一回の投与でジストロフィンタンパク質の回復効果が12ヶ月に渡って継続していることが確認できました(図2)。
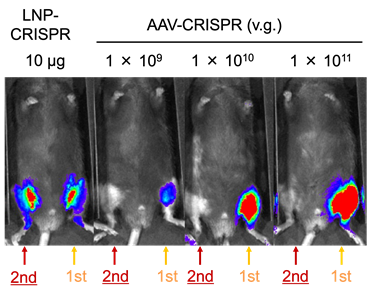
LNP-CRISPRは繰り返し投与することができる
次に、目的のゲノム編集が起こった際に、ルシフェラーゼが働いて光る仕組みをもたせたマウスに、複数回投与の実験を行いました。新規開発したLNP-CRISPRと従来型のAAV-CRISPRをマウスの片脚にそれぞれ一回投与した28日後に、反対側の脚へ二回目の投与を行いました。その結果、LNPでは一回目、二回目共にルシフェラーゼの反応が見られゲノム編集活性を確認できましたが、AAV-CRISPRでは二回目に投与した部分での反応が見られませんでした(図3)。LNPは繰り返し利用し、ゲノム編集を起こすことができることが確認できました。
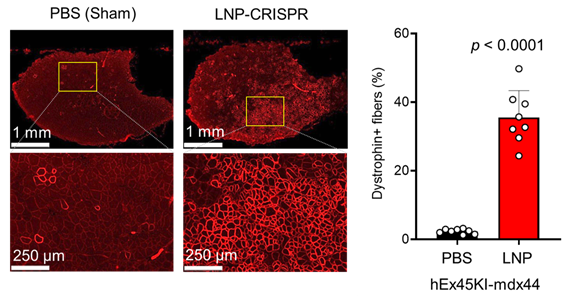
筋ジストロフィーモデルマウス(hEx45KI-mdx44)に、LNP-CRISPRを筋肉注射で二週間かけて6回投与し、投与した部分の筋肉の様子を顕微鏡で観察したところ、LNPを投与しなかった場合(PBS)はほとんどジストロフィンタンパク質がみられませんでしたが、LNP-CRISPRを投与した場合(LNP-CRISPR)は38.5%の筋線維でジストロフィンタンパク質(写真の赤く発光している部分)が陽性となっていることが観察できました(図4)。
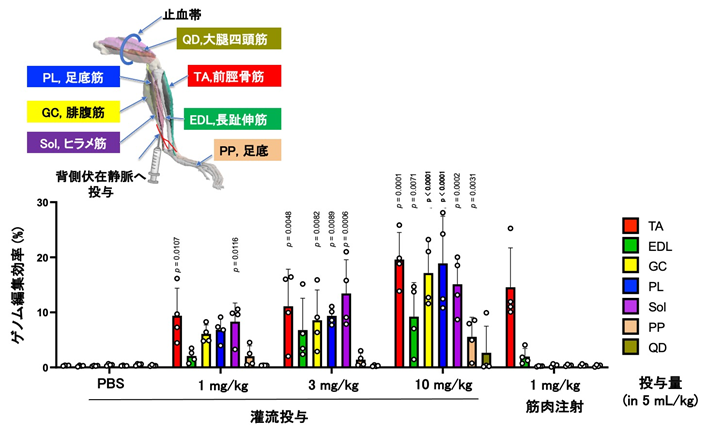
灌流により広範囲の筋肉に届けられる
体を動かすためには複数の筋群を修復する必要があります。一回の投与で多くの筋群を修復できるように、マウスの大腿四頭筋(QD)を止血帯で縛り、足首の静脈(伏在静脈)からLNP-CRISPRを灌流投与しました。前脛骨筋(TA)に筋肉注射した場合はTAでのみゲノム編集が起きていたのに対し、灌流投与をした場合は止血帯をしていたQDを除き、多くの筋肉でゲノム編集が起きていました(図5)。
まとめ
本研究では、ゲノム編集を起こすためのCRISPR-Cas9 mRNAおよびガイドRNAを骨格筋組織へ繰り返し投与可能なLNP輸送システムを開発しました。
筋ジストロフィーの病態がおよぶ骨格筋は体重の約4割を占め、各筋肉は筋膜によって分離されているため、ゲノム編集薬剤を一回の投与ですべての骨格筋組織に行き渡らせることは困難です。そのため、今回のように複数回投与できる方法が必要になります。従来の薬剤であれば、時間が経つと最初に投与した効果が薄れてしまいますが、ゲノム編集の場合、一年に渡って効果が持続することが分かりました。このため、LNP-CRISPRを複数回投与することで徐々に治療範囲を広げていく方法が有効ではないかと期待しています。
有効性と安全性を確保するためにはさらなる研究と評価が必要ですが、本研究成果は筋ジストロフィーを始めとしたゲノム編集療法の開発に向けた重要なステップといえます。
論文名と著者
- 論文名
- “Low immunogenicity of LNP allows repeatedadministrations of CRISPR-Cas9 mRNA intoskeletal muscle in mice”
- ジャーナル名
- Nature Communications
- 著者
- Eriya Kenjo1,2, Hiroyuki Hozumi1,2, Yukimasa Makita1,2, Kumiko A. Iwabuchi2,3, Naoko Fujimoto2,3, Satoru Matsumoto1,2, Maya Kimura1, Yuichiro Amano1, Masataka Ifuku2,3, Youichi Naoe2,3, Naoto Inukai1,2, and Akitsu Hotta2,3,*.
*責任著者 - 著者の所属機関
-
- 武田薬品工業株式会社
- タケダ-CiRA 共同研究プログラム(T-CiRA)
- 京都大学iPS細胞研究所(CiRA)
- URL
- https://www.nature.com/articles/s41467-021-26714-w
本研究への支援
本研究は、下記機関より支援を受けて実施されました。
- 武田薬品工業株式会社「T-CiRA共同研究プログラム」
- 日本医療研究開発機構(AMED)
「産学連携イノベーション創出プログラム(ACT-M)」 JP20im0210115
用語説明
- 注1)デュシェンヌ型筋ジストロフィー
- X染色体上のジストロフィン遺伝子の異常により、ジストロフィンタンパク質が作られないために発症する。筋ジストロフィーの中でもデュシェンヌ型は最も重症であり、日本国内で1500~3000名程度の患者がいるとされている。ジストロフィンタンパク質は筋細胞で、細胞膜と細胞骨格を連結する巨大タンパク質であり、これが欠失すると筋細胞が脆弱になる。遺伝子変異のタイプに応じて、対象となるエクソン(遺伝子中の、タンパク質をコードする配列)をスキッピング(エクソンスキッピング; 問題のあるエクソンを読み飛ばして本来より少し短縮されたタンパク質を得られる)することにより、ジストロフィンタンパク質を回復できる。
- 注2)脂質ナノ粒子(LNP)
- 脂質を主成分とする粒子で、内側に薬となるDNAやRNAなどを内包させて、細胞へと薬物を輸送するシステムとして利用されている。新型コロナウイルスに対するmRNAワクチンでも使われている。
- 注3)CRISPR-Cas9
- CRISPR(Clustered Regularly Interspaced Short Palindromic Repeat)という塩基配列とCas9というDNA切断酵素と、切断させたい場所へとCas9を誘導するガイドRNAを使うことで、任意の場所のDNAを切断することができる。ゲノム編集技術の一つ。
- 注4)アデノ随伴ウイルス(AAV)
- 遺伝子を細胞内に送り込むために使われる代表的なウイルスの一つ。様々な細胞に遺伝子導入が可能であり、動物個体への遺伝子導入にも適しているため、広く用いられている。
- 注5)中和抗体
- ウイルス等の病原体(ここでは、AAVベクター)の働きを弱めて、生体を防御する機能を持った抗体。
- 注6)灌流
- 臓器・組織に薬液などが入った液体を流し込むこと。血管網を通って組織内に広く薬液が行き渡る。
- 注7)ルシフェラーゼ
- 発光物質が光を放つ反応を進める酵素。
- 注8)カチオン化脂質
- RNAなどの核酸は通常負に帯電した状態にあるため、細胞膜を通過できない。脂質を正に帯電した陽イオン(カチオン)にすることで、RNAなどを内包したLNP形成が可能になる。
- 注9)核酸医薬
- ここでは、ジストロフィンタンパク質を(エクソンスキッピングにより)回復させるために用いられる短い核酸配列。点滴で投与できるが、血中半減期が短いために毎週の繰り返し投与が必要。また、投与を停止するとジストロフィンタンパク質が再び消失してしまう。
お問い合わせ先
研究内容およびCiRAに関する問い合わせ先
京都大学iPS細胞研究所(CiRA)国際広報室
E-mail:media"AT"cira.kyoto-u.ac.jp
T-CiRAに関する問い合わせ先
武田薬品工業株式会社 リサーチ T-CiRAディスカバリー
E-mail:T_CiRA"AT"takeda.co.jp
AMED事業に関する問い合わせ先
日本医療研究開発機構
実用化推進部 研究成果展開推進課
電話番号:03-6870-2214
E-mail:sangaku-i"AT"amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
掲載日 令和4年1月12日
最終更新日 令和4年1月12日


