成果情報 シグナル伝達複合体の2段階活性化―GPCRによるアレスチンの動的な活性化機構を解明―
成果情報
次世代天然物化学技術組合
理化学研究所
日本医療研究開発機構
Gタンパク質共役型受容体(GPCR)[1]は、細胞外の刺激を細胞内に伝える役割を担う重要な膜タンパク質です。さまざまな生理機能や疾患に関わるため、GPCRを標的とした医薬品の開発が世界中で進められています。このような医薬品は、GPCRと結合することでGタンパク質[1]とアレスチン[2]の二つの細胞内タンパク質を活性化しますが、GPCRによるアレスチンの活性化の仕組みはよく分かっていませんでした。
次世代天然物化学技術組合 技術顧問/理化学研究所(理研)生命機能科学研究センター生体分子動的構造研究チーム 嶋田一夫チームリーダー、白石勇太郎研究員らの国際共同研究グループ※は、さまざまな医薬品の標的タンパク質であるGPCRが、2段階の動的な過程を経て細胞内に刺激を伝える新たな仕組みを解明しました。すなわち、医薬品の結合に伴うGPCRの膜貫通領域(TMコア)の活性化とC末端[3]領域(Cテール)のリン酸化[4]が、アレスチンとのシグナル伝達複合体の形成にどのような役割を果たしているかを解析しました。その結果、GPCRとアレスチンは、まずリン酸化されたCテールを介した強い結合によりGPCR-アレスチン複合体を形成し、続いて起こるTMコアとの弱い結合がアレスチンに大きな構造変化を導き、活性化させるという、2段階の動的な過程を示すことが明らかになりました。
本研究成果は、GPCRを標的とした医薬品の作用機序の理解や、副作用の少ない医薬品の開発に貢献すると期待できます。
- ※国際共同研究グループ
-
- 理化学研究所 生命機能科学研究センター 生体分子動的構造研究チーム
- チームリーダー 嶋田 一夫(しまだ いちお)(次世代天然物化学技術組合 技術顧問)
- 研究員 白石 勇太郎(しらいし ゆうたろう)
- 東京大学大学院 薬学系研究科 生命物理化学教室
- 准教授 上田 卓見(うえだ たくみ)
- 助教 幸福 裕(こうふく ゆたか)
- インド工科大学カンプール校
- 准教授 アルン・シュクラ(Arun K. Shukla)
- 研究員 シュビィ・パンディ(Shubhi Pandey)
- 研究員 ヘムラタ・ディヴェディ(Hemlata Dwivedi)
研究開発のポイント
- 医薬品の結合に伴うGPCRの膜貫通領域(TMコア)の活性化とC末端領域(Cテール)のリン酸化が、アレスチンとのシグナル伝達複合体の形成にどのような役割を果たしているかを解析した。
- GPCRとアレスチンは、まずリン酸化されたCテールを介した強い結合によりGPCR-アレスチン複合体を形成し、続いて起こるTMコアとの弱い結合がアレスチンに大きな構造変化を導き、活性化させるという、2段階の動的な過程を示すことを明らかにした。
背景
Gタンパク質共役型受容体(GPCR)は、さまざまな生理機能に関わる極めて重要な膜タンパク質ファミリーです。GPCRを標的とした医薬品は、米国食品医薬品局(FDA)承認薬の30%以上を占めており、その対象は糖尿病などの代謝疾患、高血圧などの循環器疾患、喘息などの呼吸器疾患、パーキンソン病などの神経変性疾患など多岐にわたります。
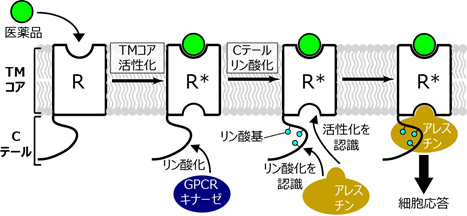
GPCRに医薬品が結合すると、二つの経路を介して刺激が伝わり、細胞が応答します。一つは、GPCRが細胞内のGタンパク質を活性化して誘起される細胞応答です。もう一つは、医薬品の結合に伴ってリン酸化されたGPCRに、アレスチンと呼ばれるタンパク質が結合し、活性化する経路です。活性化したアレスチンは、Gタンパク質を介した細胞応答を抑制するとともに、他の特定の細胞応答を誘起することが分かっています。
Gタンパク質を介した細胞応答とアレスチンを介した細胞応答は、それぞれが医薬品の主作用に加えて副作用を引き起こすため、どちらか一方の細胞応答だけを選択的に制御できる化合物は、副作用を誘起しない優れた医薬品になり得ます。このことから、アレスチンの活性化機構の理解は生物学的に重要な課題であるとともに、GPCRを標的とした医薬品開発にも大きく貢献します。
医薬品がGPCRに結合すると、膜貫通ドメイン(TMコア)の活性化と、C末端領域(Cテール)のリン酸化が起こります(図1)。アレスチンはTMコアとCテールの2カ所でGPCRと結合することで、シグナル伝達複合体を形成することが分かっていますが、これらの結合がどのようにアレスチンを活性化させるかは十分に理解されていませんでした。
研究概要
今回、本研究グループは、アレスチンとの結合親和性だけを強める変異を施したGPCR(β2-アドレナリン受容体[5]の変異体)と、アレスチン(β-アレスチン1)の相互作用を対象として、医薬品の結合に伴うβ2-アドレナリン受容体のTMコア活性化とCテールリン酸化が、アレスチンとの結合強度やアレスチンの構造に与える影響を解析しました。
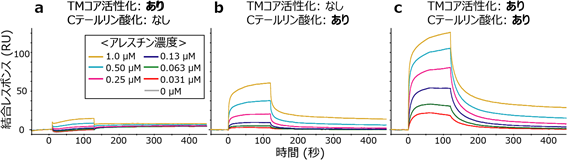
まず、β2-アドレナリン受容体とアレスチンの結合強度を、表面プラズモン共鳴(SPR)法[6]を用いて調べました。その結果、Cテールがリン酸化されていないβ2-アドレナリン受容体はアレスチンとの結合をほとんど示さない一方で、Cテールがリン酸化されたβ2-アドレナリン受容体はアレスチンと強く結合することが分かりました(図2a、b)。また、Cテールがリン酸化された条件においては、TMコアの活性化に伴いアレスチンとの結合親和性がさらに増強することが分かりました(図2c)。以上の結果は、β2-アドレナリン受容体とアレスチンの複合体形成が、Cテールのリン酸化により駆動されることを示しています。
次に、β2-アドレナリン受容体との相互作用に伴い、アレスチンにどのような構造変化が生じるかを溶液核磁気共鳴(NMR)法[7]で調べました。アレスチンの構造は、N末端[3]側のNドメインとC末端側のCドメインに大きく分けられます。アレスチンの不活性化状態(アレスチン単独状態)と活性化状態(β2-アドレナリン受容体のTMコア・Cテールの両方と結合した状態)のNMRスペクトルを比較したところ、主にNドメインとCドメインの界面に分布する八つのアミノ酸残基(I31、I168、I207、I214、I241、I314、I317、I386)のNMRシグナルに著しい化学シフト[8]差を検出しました(図3)。これは、アレスチンの活性化に伴い二つのドメインの相対配置が変化することを示しています。
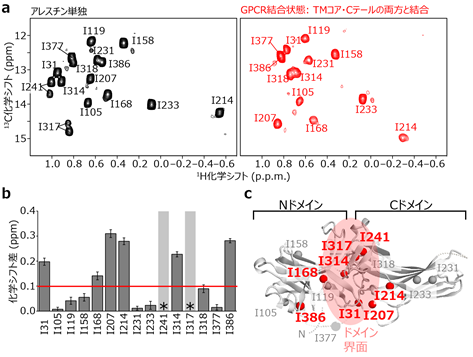
- 不活性化状態に対応するアレスチン単独(左、黒)、および活性化状態に対応するβ2-アドレナリン受容体のTMコア・Cテールの両方と結合した状態(右、赤)のNMRスペクトル。活性化状態においてI241、I317は検出限界未満まで強度が減少している。
- 活性化に伴う残基ごとの化学シフト変化量。
- 著しい化学シフト変化を示した残基のアレスチン立体構造上の分布。0.1ppm以上の化学シフト変化を示した残基を赤で示した。
一方で、β2-アドレナリン受容体のCテールのみと結合した状態のアレスチンのNMRスペクトルを調べると、活性型に対応する挙動を示したアミノ酸残基は三つ(I158、I241、I317)だけであり、I31、I105、I207、I233、I386は不活性型・活性型の両方のシグナルが検出されていました(図4a)。この結果は、Cテールとだけ結合したアレスチンは、不活性型と活性型の間を行き来する状態にあり、安定な活性型構造を形成していないことを示しています。
以上の結果から、β2-アドレナリン受容体によるアレスチンの活性化が、まずβ2-アドレナリン受容体のCテールとの強い結合により複合体形成を開始し、続いて起こるTMコアとの弱い結合が大きな構造変化を導く、という2段階の動的な過程であることが明らかになりました(図4b)。
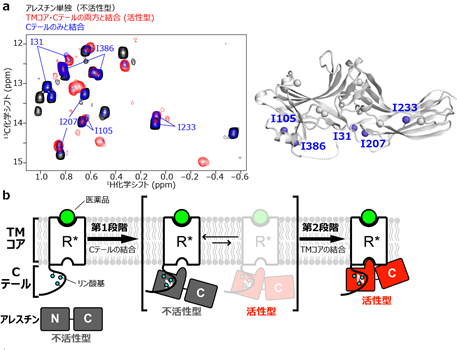
- 不活性化状態に対応するアレスチン単独(黒)、活性化状態に対応するβ2-アドレナリン受容体のTMコア・Cテールの両方と結合した状態(赤)、β2-アドレナリン受容体のCテールのみと結合した状態(青)のNMRスペクトルの比較。Cテールだけが結合した状態で、不活性型・活性型の両者が検出された残基を、立体構造上で青色で示した。
- β2-アドレナリン受容体によるアレスチンの2段階活性化。まず、結合強度が強いCテールを介してβ2-アドレナリン受容体との複合体形成が促され、続いて起こるTMコアとの弱い結合がアレスチンの構造を活性型へ移行させる。
本研究は、オンライン科学雑誌『Nature Communications』(2021年12月9日付:日本時間12月9日)に掲載されました。
今後の展開
本研究により、医薬品と結合したβ2-アドレナリン受容体によるアレスチンの活性化が、β2-アドレナリン受容体のCテールを介した強い結合による複合体形成と、TMコアとの弱い結合により誘起される構造変化の2段階で達成される動的な過程であることが明らかになりました。
GPCRを標的とした医薬品のアレスチン活性化能は、従来はアレスチンの結合親和性のみを指標としていましたが、本研究の結果は、アレスチンに誘起される構造変化を指標に加えることで、医薬品によるアレスチン活性化能をより正確に評価できることを示しています。このような活性評価法は、GPCRを標的とした新しい医薬品の開発に貢献すると期待できます。
本研究は、GPCRとアレスチンが、二つの異なる構造領域を介した相互作用により、その活性を制御していることを示しています。このような広い界面でのタンパク質間相互作用を標的とした医薬品を開発するには、従来の低分子医薬品よりも、分子サイズが大きく広い構造領域を認識できる中分子医薬品[9]を用いることが有効です。本研究で得られた知見は、このような中分子創薬を実現するための指針となることが期待されます。
用語解説
- [1]Gタンパク質共役型受容体(GPCR)、Gタンパク質
- GPCRは、細胞膜表面に発現し、細胞外からの刺激を受容して、細胞内のGタンパク質を活性化することで細胞応答を引き起こす膜タンパク質の総称。細胞膜をαヘリックスが7回貫通する構造を特徴とする。GPCRはG protein-coupled receptorの略。Gタンパク質は、グアニンヌクレオチド結合タンパク質の総称。グアノシン二リン酸(GDP)が結合している不活性型と、グアノシン三リン酸(GTP)が結合している活性型の間でタンパク質のコンフォメーションが変化し、分子スイッチとして働く。
- [2]アレスチン
- GPCRの膜貫通ドメイン、リン酸化を受けたC末端領域を認識して結合する細胞内タンパク質。Gタンパク質の活性化を阻害するとともに、Gタンパク質とは異なる細胞応答を引き起こす役割を持つ。
- [3]C末端、N末端
- タンパク質はアミノ酸同士が脱水縮合して形成されたポリマーであり、隣接するアミノ酸は、それぞれのアミノ基とカルボキシ基がペプチド結合をしている。このポリマーの末端のフリーのアミノ基側をN末端、カルボキシ基側をC末端と呼ぶ。
- [4]リン酸化
- タンパク質を構成するアミノ酸のうち、セリン、スレオニン、チロシン残基の持つ水酸基(-OH)に、リン酸基が付加される反応。リン酸基の付加は細胞内のシグナル伝達の制御に重要な役割を果たす。医薬品が結合したGPCRは、GPCRキナーゼ(GRK)によってC末端のセリン残基やスレオニン残基がリン酸化される。
- [5]β2-アドレナリン受容体
- 平滑筋の弛緩などに関わるGPCRの一種。β2-アドレナリン受容体を標的にした医薬品は、気管支喘息などの治療に用いられている。
- [6]表面プラズモン共鳴(SPR)法
- センサー表面に分子を固定化し、他の分子との相互作用をリアルタイムで測定できる相互作用解析手法。本研究ではセンサー表面にβ2V2R(β2-アドレナリン受容体の変異体)を固定化し、β-アレスチン1を添加することでその相互作用を測定した。SPRはSurface Plasmon Resonanceの略。
- [7]溶液核磁気共鳴(NMR)法
- 溶液中の生体分子などを強い磁場中に置き、生じる原子核の共鳴現象を観測することで、生体分子の構造や運動性を原子レベルで調べられる分光法。NMRはNuclear Magnetic Resonanceの略。
- [8]化学シフト
- 核磁気共鳴の共鳴周波数は、同じ核種であっても周辺の化学環境によって異なるため、化学シフトと呼ばれる。タンパク質結合などの刺激に応じた化学シフトの変化を解析することにより、その刺激に伴う構造変化部位を同定できる。
- [9]中分子医薬品
- 低分子医薬品と、抗体医薬品などの高分子医薬品の中間に位置付けられ、分子量が数百から数千程度の領域にある医薬品群。タンパク質間相互作用のように広い相互作用界面を標的とすることが可能。
特記事項
論文情報
- タイトル
- Biphasic activation of β-arrestin 1 upon interaction with a GPCR revealed by methyl-TROSY NMR
- 著者名
- Yutaro Shiraishi, Yutaka Kofuku, Takumi Ueda, Shubhi Pandey, Hemlata Dwivedi-Agnihotri, Arun K. Shukla, Ichio Shimada
- 雑誌
- Nature Communications
- DOI
- 10.1038/s41467-021-27482-3
お問い合わせ先
研究に関するお問い合わせ先
理化学研究所 生命機能科学研究センター 生体分子動的構造研究チーム
チームリーダー 嶋田 一夫(しまだ いちお)
(次世代天然物化学技術組合 技術顧問)
研究員 白石 勇太郎(しらいし ゆうたろう)
AMED事業に関するお問い合わせ先
日本医療研究開発機構
創薬事業部 医薬品研究開発課
次世代治療・診断実現のための創薬基盤技術開発事業担当
E-mail:jisedai-med“AT”amed.go.jp
E-mailは上記アドレス“AT”の部分を@に変えてください。
関連リンク
掲載日 令和4年1月27日
最終更新日 令和4年1月27日


