成果情報 血管ががん細胞を転移させるユニークな仕組みを解明―転移を抑える新たな抗がん剤の開発に期待―
成果情報
慶應義塾大学医学部
日本医療研究開発機構
慶應義塾大学医学部解剖学教室の久保田義顕教授、同外科学教室(一般・消化器)、同内科学教室(循環器)、同医化学教室、同先端医科学研究所、浜松医科大学、英国オックスフォード大学らの共同研究グループは、がん内部の血管でのみ利用されている構造維持因子として、神経ガイダンス因子として知られてきたFLRT2(注1)を見出し、FLRT2の発現量がヒト大腸がんの予後と逆相関すること、血管でFLRT2を欠損したマウスでは、がんの転移が抑えられることを明らかにしました。
がんの進行、転移には、血管ががん内部へ成長することが原因とされます。そのため、血管の成長をとめる薬剤(VEGF(注2)阻害剤など)が広く臨床の現場では用いられていますが、がんの転移に関しては抑える効果が不十分なケースもみられ、がん転移をより効率的に抑える新たな分子標的が模索されてきました。
本研究では、FLRT2がヒト大腸がん、特に進行がんの血管で強く発現し、その発現量は予後と逆相関していることを見出しました。次に血管特異的にFLRT2遺伝子を欠損したマウスの皮膚にがん細胞を移植したところ、隙間の多い血管(がん転移の出入り口となる)が著減し、肺や肝臓への転移が大幅に減少することを見出しました。さらには、この血管の変化(隙間の多い血管が減少)によりがん深部まで血流を運ぶことができるようになり、免疫チェックポイント阻害剤(注3)である抗PD-1抗体の効果が顕著に増強されることもわかりました。
本研究成果は、血管ががん細胞を転移させるユニークな仕組みを解明したものであり、実用化の観点からは、従来の血管の成長をとめる薬剤では不十分であった、がん転移を効率的に抑える画期的な分子標的薬の開発につながることが期待されます。さらには、免疫チェックポイント阻害剤の効果を最大限に発揮させるための、「地ならし」的な併用療法への応用も期待されます。
本研究成果は2022年2月1日(米国東部時間)の『The Journal of Clinical Investigation』オンライン版に掲載されました。
研究の背景
がんの進行、転移には、血管ががん内部へ成長することが原因とされます。そのため、血管の成長をとめる薬剤によって、がんの進行、転移は抑えらえると考えられ、そうした薬剤が既に臨床のがん治療の現場において用いられています。特に2004年に米国FDA、2007年に厚労省によって認可された、血管内皮成長因子(VEGF)の阻害剤は、大腸がん、肺がんなど多くのがんで有意な治療効果が認められています。その一方、VEGF阻害剤はがんの転移に関しては、抑える効果が不十分なケースもみられ、そのメカニズムについて世界的に解析が進められるとともに、がん転移を効率的に抑える新たな分子標的が探索されてきました。
研究の概要と成果
本研究ではまず、本研究チームが長らく注目してきた神経ガイダンス因子FLRT2について、慶應義塾大学医学部外科学教室に保管されていた多数のヒト大腸がんサンプルでの発現を解析しました。予想外の結果として、FLRT2はがんの血管、特に進行がんの血管で強く発現し、その発現を定量化したところ、患者予後と逆相関していることを見出しました。これは病理サンプルにおけるFLRT2の発現が、患者予後を予測する因子として有用であることを示しています。
次に血管特異的にFLRT2遺伝子を欠損したマウスを作成し、がんモデルを適用したところ、皮膚に発生したがん(原発巣)において、血管内部へのがん細胞の侵入が顕著に抑えられ、その結果、肺や肝臓への遠隔転移が8割程度減少することを見出しました(図1)。一方、VEGF阻害剤投与を模倣するマウス(VEGF受容体欠損マウス)を作成しましたが、FLRT2欠損マウスとは逆に、がん転移が増加していることを見出しました。
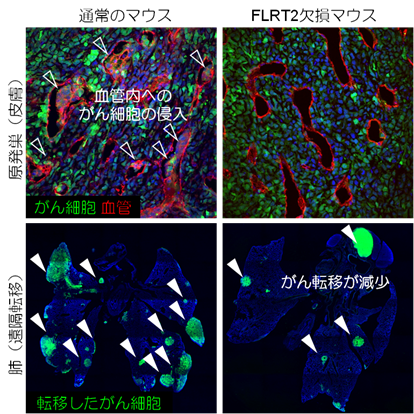
続いてそのメカニズム、つまり『血管におけるFLRT2欠損が何故がん転移を減少させるのか?』についてさまざまなアプローチで検討しました。その結果、驚くべきことに、FLRT2はがんの血管に特有な隙間の多い(幼弱な)血管に強く発現し、その血管細胞同士をつなぎ留め(血管細胞間のアンカーとして)、がん特有な血管構造を維持していることを見出しました。そもそもがん細胞は、幼弱な血管の隙間を通して血管内に侵入し、血流に乗って転移するので、FLRT2が無くなることにより幼弱な血管が消滅し、転移ができなくなります(図2)。
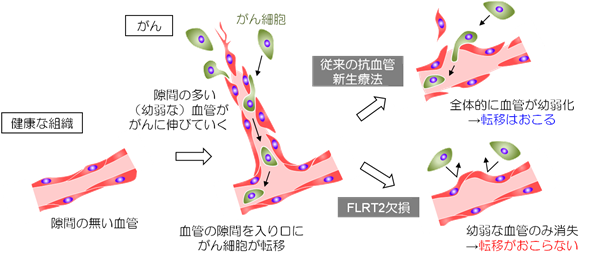
さらにはFLRT2欠損がもたらす特筆すべき事項として、上記のようにFLRT2欠損マウスのがんでは隙間の無い、安定した血管のみ残るため、がん深部まで血流を運ぶことができるようになります。また、免疫チェックポイント阻害剤である抗PD-1抗体の効果が顕著に増強されることもわかりました。これはFLRT2を阻害する薬剤はPD-1抗体との併用療法として期待されることを示唆しています。
研究の意義・今後の展開
本研究成果は、血管ががん細胞を転移させるユニークな仕組みを解明したものであり、実用化の観点からは、少なくともFLRT2の発現が、ヒト大腸がんにおける新規予後予測因子として有用であることは判明しています。今後は、ヒトでFLRT2の働きを特異的に抑えられる薬剤の開発が目標となりますが、もしこれが成し遂げられれば、従来の血管の成長を止める薬剤では不十分であった、がん転移を効率的に抑える画期的な分子標的薬となることが期待されます。さらには、免疫チェックポイント阻害剤をがんの奥まで深達させ、その効果を最大限にさせるための、「地ならし」的な併用療法への応用も期待されます。
特記事項
本研究は、国立研究開発法人日本医療研究開発機構(AMED) 革新的先端研究開発支援事業(PRIME)「生体組織の適応・修復機構の時空間的解析による生命現象の理解と医療技術シーズの創出」研究開発領域における研究開発課題「血管・リンパ管の独立性を担保する分子機構とその病態への応用」(研究開発代表者:久保田義顕)、国立研究開発法人科学技術振興機構ムーンショット型研究開発事業「神経グリア血管単位-リンパ管系に着目した血管性認知症および混合型認知症における臓器間ネットワークの解明とヒトへのトランスレーションによるリスク予見法の創出」の支援を受けました。
論文について
- 英文タイトル
- Tumor-specific inter-endothelial adhesion mediated by FLRT2 facilitates cancer aggressiveness
- タイトル和訳
- FLRT2により維持される腫瘍特異的血管内皮細胞間接着はがんの攻撃性を増強させる
- 著者名
- 安藤知史、田井育江、杉浦悠毅、楠本大、岡林剛史、木戸泰明、佐藤康二、 佐谷秀行、Sutip Navankasattusas、Dean Li、末松誠、北川雄光、Elena Seiradake、 山岸覚、久保田義顕
- 掲載誌
- The Journal of Clinical Investigation(オンライン版)
- DOI
- 10.1172/JCI153626
用語解説
- (注1)FLRT2:2型フィブロネクチンロイシンリッチリピート膜貫通タンパク質
- 反発性神経ガイダンス因子、つまり神経が伸びる際に、このタンパク質が存在するエリアには神経が入っていかないようにはたらく。近年、血管細胞に関しても何らかの役割があることが示唆されてきた。
- (注2)VEGF:血管内皮細胞成長因子(Vascular endothelial growth factor)
- 1989年、Napoleon Ferraraらによって発見されたタンパク質。強力な血管に対する増殖作用を有し、生体内における血管の発生、伸展に必須の分泌性タンパク質である。遺伝学的VEGFを欠損させたマウスでは体内に血管が全くつくられず、胎生初期に致死となる。
- (注3)免疫チェックポイント阻害剤
- Tリンパ球の活性、つまり免疫反応にブレーキをかける免疫チェックポイントシステム(その個体自身の細胞(がん細胞含む)に攻撃しないようにする分子機構)を解除する薬剤。この薬剤の投与により、Tリンパ球の免疫のブレーキが解除され、がん細胞に対する攻撃が強力に促進される。京都大学の本庶佑博士のノーベル医学生理学賞受賞(2018年)の対象となった研究成果。
お問い合わせ先
本発表資料に関するお問い合わせ先
慶應義塾大学医学部 解剖学教室
久保田 義顕(くぼた よしあき)教授
TEL:03-5315-4358 FAX:03-5315-4359 Email:ykubo33"AT"a3.keio.jp
慶應医学部・解剖学教室(久保田研究室)
本リリースの配信元
慶應義塾大学 信濃町キャンパス総務課:山崎・飯塚・奈良
〒160-8582 東京都新宿区信濃町35
TEL:03-5363-3611 FAX:03-5363-3612 Email:med-koho"AT"adst.keio.ac.jp
慶應義塾大学医学部・医学研究科
AMED 事業に関するお問い合わせ先
日本医療研究開発機構(AMED)
シーズ開発・研究基盤事業部 革新的先端研究開発課
革新的先端研究開発支援事業(PRIME)
TEL:03-6870-2224 FAX:03-6870-2246 E-mail:kenkyuk-ask”AT”amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
関連リンク
掲載日 令和4年2月22日
最終更新日 令和4年2月22日


