学習・記憶を制御するアセチルコリンの神経細胞内シグナル伝達機構を解明―アルツハイマー型認知症の新治療法の開発に期待―
成果情報
藤田医科大学
日本医療研究開発機構
発表のポイント
- マウス脳の線条体・側坐核スライスを用いて、アセチルコリンがムスカリン受容体M1Rを介してリン酸化酵素 PKCを活性化することを見出しました。
- 独自に開発したリン酸化プロテオミクス法(注1)により、PKCの基質候補を包括的に探索し、低分子量Gタンパク質Rac(注2)の活性化因子β-PIXを含む116種類のタンパク質をPKCの基質として同定しました。
- PKCがβ-PIXをリン酸化して活性化し、その結果、Racの標的タンパク質 p21 activated kinase(PAK)を活性化することを見出しました。
- PAKが、アセチルコリンの下流で忌避学習(注3)・嫌悪記憶を制御していることを明らかにしました。
- ドネペジル(認知症治療薬)がM1R-PKC-β-PIXを介してPAKを活性化し、その結果、マウスの忌避学習・嫌悪記憶を促進することを示しました。
- マウスを用いた実験でアセチルコリンとドネペジルの細胞内シグナル伝達機構を明らかにしたことにより、アルツハイマー型認知症の新しい治療法の開発に繋がることが期待されます。
発表概要
藤田医科大学精神・神経病態解明センター 貝淵弘三教授、山橋幸恵助教らの研究グループは、不快情動である忌避学習・嫌悪記憶の形成に至るアセチルコリンの神経細胞内シグナル伝達機構を解明しました。
脳内の神経伝達物質(注4)アセチルコリンの重要性は、アルツハイマー型認知症患者の学習・記憶の低下がアセチルコリン濃度の低下と関わっていることが1970年代に発見されて以来、多くの研究者に認識されていました。ドネペジルは、日本ではアルツハイマー型認知症治療薬として保険適用されており、記憶・学習の低下などの認知症症状の進行を抑えることが知られています。しかし、学習・記憶に至るアセチルコリンの細胞内におけるシグナル伝達機構は、今も不明な点が多く、アセチルコリンの細胞内シグナル伝達経路をターゲットとしたアルツハイマー型認知症の治療開発も進んでいません。
本研究では、独自に開発したリン酸化プロテオミクス法を駆使し、アセチルコリンがPKCを介してβ-PIX及びその下流分子であるPAKを活性化することを見出しました。この経路を介して、アセチルコリン及びドネペジルが忌避学習・嫌悪記憶を亢進することも明らかにしました。
本研究でアセチルコリンのシグナル伝達機構を解明したことにより、アセチルコリンの細胞内シグナル伝達経路をターゲットとしたアルツハイマー型認知症の新しい治療法の開発に繋がることが期待されます。
研究成果と詳細は、国際科学誌Molecular Psychiatryに、2022年6月3日に発表されました。
研究の背景
脳内のアセチルコリンが学習・記憶に重要であることは、アセチルコリンエステラーゼ阻害剤(注5)であるドネペジルにより示されています。アセチルコリンが快・不快などの情動行動を司る線条体・側坐核に最も多く存在することから、情動行動におけるアセチルコリンの役割について多く研究されてきました。その結果、ムスカリン性アセチルコリン受容体M1Rが忌避学習と関わっていることが示されています。
シグナル伝達経路に関しては、M1RがプロテインキナーゼC(PKC)を介してシグナル伝達することが知られています。しかし、PKCの下流シグナルを解明する手段がなく、神経細胞内におけるアセチルコリンのシグナル伝達経路の全容解明には至っていません。代表的な認知症治療薬ドネペジルも根本的治療には至っておらず、新しい治療薬の開発のためにも重要な課題となっています。
研究の内容
マウス脳の線条体・側坐核スライスを用いて、アセチルコリンがM1Rを介してリン酸化酵素 PKCを活性化することを明らかにしました。これを踏まえ、独自に開発したリン酸化プロテオミクス法により、PKCの基質候補を包括的に探索し、低分子量Gタンパク質Racの活性化因子β-PIXを含む116種類のタンパク質をPKCの基質として同定しました。
電気ショックによる嫌悪刺激が線条体・側坐核でのアセチルコリン濃度を上昇させることが知られています。マウスに嫌悪刺激として電気ショックを与えると、①アセチルコリンの下流下でPKCがβ-PIXをリン酸化して活性化し、その結果、Racの標的タンパク質PAKを活性化すること、②PAKが、アセチルコリンの下流で忌避学習・嫌悪記憶を制御していることを見出しました。
ドネペジルはラットなどのモデル動物で脳内のアセチルコリン濃度を上昇させて学習・記憶の障害を改善することが知られていました。今回、ドネペジルがM1R-PKC-β-PIX経路を介してPAKを活性化し、その結果、忌避学習・嫌悪記憶を促進することを明らかにしました。以上の結果を基に、アセチルコリンとドネペジルの細胞内シグナル伝達機構を明らかにしました(図1参照)。
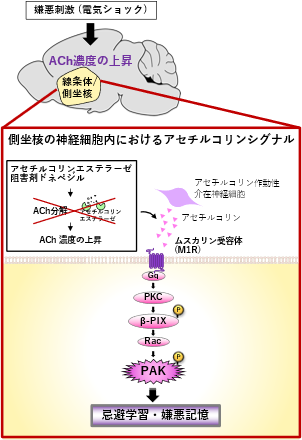
本研究では更に、ドネペジルが海馬内のCA1領域におけるPAKも活性化することを明らかにしました。また、アセチルコリンと関わる認知記憶や連合学習がPAKに依存することも見出しました。これらの結果から、アセチルコリンがPAKを介して海馬に依存した学習・記憶にも関与することが示唆されました。
今後の展望
本研究では、忌避学習・嫌悪記憶に至るアセチルコリンの下流のシグナル伝達がM1R-PKC-β-PIX-Rac-PAK経路であることが分かりました。忌避学習・嫌悪記憶は、動物実験におけるアルツハイマー型認知症治療薬のスクリーニングの評価指標として使われています。本研究で同定したアセチルコリンのシグナル伝達経路を活性化することがアルツハイマー型認知症患者の忌避学習の障害の改善に繋がることが考えられます。実際、アルツハイマー型認知症患者ではPAKが不活性化していることが報告されています。この可能性の検証のために、先ず、アルツハイマー型認知症の疾患モデル動物を用いて、このシグナル伝達機構の破綻と学習・記憶の低下との関連を明らかにすることを考えています。
用語解説
- (注1)リン酸化プロテオミクス法
- リン酸化酵素によってリン酸化された蛋白質を包括的に探索するための手法。
- (注2)Rac
- 細胞形態の制御因子で、Rho ファミリー低分子量GTP結合蛋白質の一種。
- (注3)忌避学習
- 不快なものや危険なもの等の嫌悪刺激を通して得た経験により、予測される嫌悪刺激を事前に避けるように行動する過程のこと。
- (注4)神経伝達物質
- 神経から神経、神経から筋肉等の組織へ信号を伝達する低分子の化学物質のこと。
- (注5)アセチルコリンエステラーゼ阻害剤
- 神経細胞外へ放出されたアセチルコリンを分解する酵素であるアセチルコリンエステラーゼを阻害する薬物。アセチルコリンエステラーゼ阻害剤によって脳内のアセチルコリン量が増加し、アルツハイマー型認知症の患者の学習・記憶の低下の進行が抑えられる。
研究資金
本研究は、日本医療研究開発機構(AMED)脳とこころの研究推進プログラム(革新的技術による脳機能ネットワークの全容解明プロジェクト)(JP19dm0207075,JP20dm0207075,JP21dm0207075)、科研費(JP17H01380, JP19K16370, JP17H05561, JP19H05209)、分野融合型共同研究事業(生理研)、上原記念生命科学財団、武田科学振興財団の助成を受けたものです。
発表雑誌
- 雑誌名
- Molecular Psychiatry(2022年6月3日掲載)
- 論文タイトル
- Phosphoproteomic of the acetylcholine pathway enables discovery of the PKC-β-PIX-Rac1-PAK cascade as a stimulatory signal for aversive learning
- 著者
- Yukie Yamahashi, You-Hsin Lin, Akihiro Mouri, Sho Iwanaga, Kazuhiro Kawashima, Yuya Tokumoto, Yo Watanabe, Md. Omar Faruk, Xinjian Zhang, Daisuke Tsuboi, Takashi Nakano, Naoaki Saito, Taku Nagai, Kiyofumi Yamada, Kozo Kaibuchi
- 論文DOI
- 10.1038/s41380-022-01643-2
お問合せ先
研究に関すること
藤田医科大学・医科学研究センター
センター長・教授 貝淵弘三
TEL:0562-93-2683
MAIL:kaibuchi"AT"fujita-hu.ac.jp
広報に関すること
学校法人藤田学園 広報部
学園広報グループ
TEL:0562-93-2868
MAIL:koho-pr"AT"fujita-hu.ac.jp
AMED事業に関すること
日本医療研究開発機構(AMED)
疾患基礎研究事業部 疾患基礎研究課
脳とこころの研究推進プログラム
革新的技術による脳機能ネットワークの全容解明プロジェクト担当
TEL:03-6870-2286
MAIL:brain-m"AT"amed.go.jp
※MAILは上記アドレス“AT”の部分を@に変えてください。
掲載日 令和4年6月23日
最終更新日 令和4年6月23日


