成果情報 持続的なストレスによって血液脳関門の機能が低下する新たなメカニズムを発見―うつ病などのストレス性精神疾患の新たな治療法の開発へ―
成果情報
国立精神・神経医療研究センター(NCNP)
日本医療研究開発機構(AMED)
ポイント
- うつ病患者において血漿中の血管内皮増殖因子(VEGF)(※1)濃度が高いと、血液脳関門(※2)の機能が低下していることを明らかにしました。
- 慢性ストレスを受けたうつ病のモデルマウスでは、血液脳関門の機能が低下しており、そのメカニズムとしてVEGFが関与することを明らかにしました。
- 慢性ストレスマウスの血液脳関門機能低下やうつ様行動がVEGFシグナルを阻害する中和抗体により抑えられたことから、このシグナルが新たな治療標的になることが示唆されました。
概要
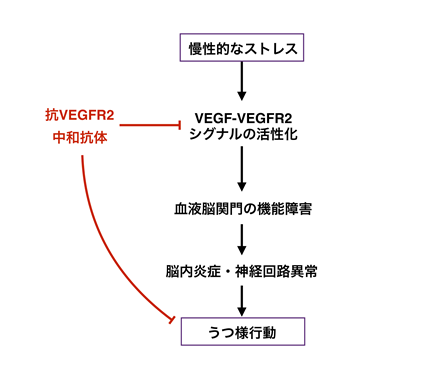
国立精神・神経医療研究センター(NCNP) 神経研究所疾病研究第三部 功刀浩(くぬぎひろし、前部長;現・帝京大学医学部精神神経科学講座主任教授)、松野(鈴木)仁美 (同研究部研究員)、惣谷和広 (同研究部前室長;現・佐賀大学医学部准教授)らの研究グループは、持続的にストレスを受けると血液と脳とを隔てている「血液脳関門」の機能が低下する新たなメカニズムを発見しました。
持続的にストレスにさらされると、血管内皮増殖因子(VEGF:vascular endothelial growth factor)というタンパク質が脳内と体内で増加し、脳と血液との境界にある血管内皮細胞のバリア構造(血液中の物質が脳内に侵入するのを防ぐ構造)の変化が生じることを明らかにしました。さらに、VEGF受容体の1つであるVEGFR 2の中和抗体がストレスによって生じる血液脳関門の機能低下を抑制し、マウスのうつ様行動を緩和することを明らかにしました。本成果により、うつ病の発症メカニズムの解明が進み、VEGFシグナルを標的とした新たな治療法の開発につながることが期待されます。
本研究成果は、2022年5月26日付(英国時間)の医学雑誌「Molecular Psychiatry」に掲載されました。
研究背景
うつ病は、世界人口の約4%が罹患しているとされる頻度の高い精神疾患であり、気分の落ち込みや興味・関心の低下、不眠など、さまざまな心身の症状を呈します。また長期的な休職や自殺などの重大な要因にもなり、現在の薬物療法では回復しない場合も多いことから、病気の原因をさらに解明し、新たな治療法の開発を行うことが急務とされています。
近年の研究から、脳を血液中の有害物質から守る「血液脳関門」がストレスなどによって障害され、それにより脳内の炎症反応が惹起されることが示唆されています。脳内炎症を引き起こす分子メカニズムが明らかになれば、新しい治療法の開発につながることが期待できます。
2015年、本研究グループはうつ病患者のうち約20%で脳脊髄液中のフィブリノーゲン値が高くなっていることを見つけ、報告しました (Hattori et al, 2015)。フィブリノーゲンは出血などの際、血液凝固において重要な働きをするタンパク質であり、健康な脳では血液脳関門の働きによって脳脊髄液中にはほぼ入ってきません。フィブリノーゲンが脳内に入ると、脳内の免疫を司る細胞であるミクログリア(※3)が活性化し、脳内炎症を引き起こします(Davalos et al, 2012)。この結果は、うつ病患者では血液脳関門の機能低下が起こることで脳内炎症が生じている可能性を示唆しています。また、うつ病患者の血液では健常者と比べて、血管透過性の亢進作用を持つ血管内皮増殖因子(VEGF:vascular endothelial growth factor)の濃度が高いことが報告されています。そこで本研究グループでは、VEGFがうつ病発症にともなう血液脳関門機能の低下に関与しているのではないかという仮説を立て、研究を行いました。
研究内容
血液脳関門は血液と脳組織間で必要な物質輸送を行う一方で、血液からの病原体や有害物質の侵入に対するバリア構造として機能し、中枢神経系の機能を正常に維持するための重要な働きを担っています。
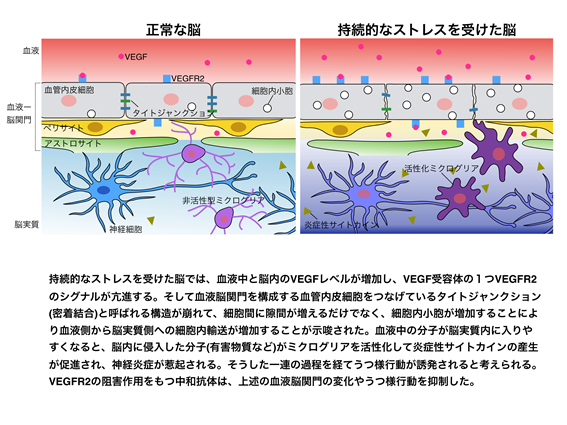
正常な脳では血液脳関門の働きにより物質の透過性は厳密にコントロールされており、脳脊髄液中のタンパク質濃度は低レベルに維持されています。脳脊髄液中での総タンパク質濃度およびフィブリノーゲン濃度が高いうつ病患者では、血液中のVEGF濃度が高い傾向があることが分かりました。さらに脳脊髄液中の総タンパク質濃度が高いうつ病患者では、脳脊髄液中の可溶性VEGFR 2(VEGFの受容体の1つ)の濃度が高い傾向を示しました。これらの結果より、一部のうつ病患者では血液中と脳内の両方でVEGFシグナルが過剰に働いていることが示唆されました。
次に、慢性拘束ストレスを与えたうつ病のモデルマウスで検討したところ、うつ様行動の発現にともなって血液中と脳内でのVEGFレベルが増加していました。そしてうつ病モデルマウスの一部の脳領域(海馬と扁桃体)で、血管の物質透過性が増大していることがわかりました。脳血管内皮細胞には「タイトジャンクション(※4)」と呼ばれる細胞同士の接着構造があり、物質の透過性が厳密にコントロールされています。うつ病モデルマウスでは、通常のマウスと比べてこの接着構造に多くの隙間ができていました。また、内皮細胞が血液中の物質を細胞内に取り込んだのちに細胞内小胞という小さな袋に入れて脳組織側へ放出する、「トランスサイトーシス(※5)」と呼ばれる輸送経路も異常に活性化していることが分かりました。血管透過性が亢進している脳領域では、ミクログリアの形態変化や、炎症性サイトカイン発現の増加が起きており、血液脳関門の機能低下により脳内炎症が誘導された可能性が示唆されました。
さらにVEGFの受容体の1つであるVEGFR 2の機能を薬理学的に阻害すると、うつ様行動の改善とともに、慢性ストレスによる血液脳関門の透過性およびバリア構造の異常が有意に抑制されました。
社会的意義・今後の展望
本研究の結果から、慢性的なストレスによって血液脳関門の機能低下が生じ、それによって脳内炎症が引き起こされていること、そのメカニズムにVEGFが関与している可能性が示されました。VEGFR2の薬理学的な阻害に抗うつ効果が認められたことより、うつ病をはじめとしたストレス性精神疾患の新たな治療薬の開発につながることが期待されます。
原著論文情報
- タイトル
- “Association between vascular endothelial growth factor-mediated blood-brain barrier dysfunction and stress-induced depression”
- 著者
- Hitomi Matsuno†, *, Shoko Tsuchimine, Kazunori O'Hashi, Kazuhisa Sakai, Kotaro Hattori1, Shinsuke Hidese, Shingo Nakajima, Shuichi Chiba, Aya Yoshimura, Noriko Fukuzato, Mayumi Kando, Megumi Tatsumi, Shintaro Ogawa, Noritaka Ichinohe, Hiroshi Kunugi, and Kazuhiro Sohya* †筆頭著者, *共責任著者
- 掲載誌
- 「Molecular Psychiatry」
- URL
- https://www.nature.com/articles/s41380-022-01618-3
- doi
- 10.1038/s41380-022-01618-3
研究経費
本研究は、日本医療研究開発機構(AMED) 創薬基盤推進研究事業および脳科学研究戦略推進プログラム、文部科学省科学研究費、国立精神・神経医療研究センター精神・神経疾患研究開発費の支援を受けて行われました。
用語説明
- (※1)血管内皮増殖因子(VEGF:vascular endothelial growth factor)
- VEGFは血管透過性を亢進させる因子として発見されたタンパク質。血管内皮細胞表面の血管内皮増殖因子受容体(VEGFR)に結合し、血管透過性の亢進、血管新生の促進など多くの作用を示す。最近ではがん、加齢黄斑変性症などさまざまな疾患との関連が報告されている。
- (※2)血液脳関門
- 血液と脳組織間のバリア構造。脳機能に必要な物質輸送を促進する一方で、血液からの病原体や有害物質の侵入を抑制している。血管内皮細胞、アストロサイト、ペリサイトといった複数の細胞と基底膜により構成されており、物質の透過性は、主に血管内皮細胞の細胞間接着構造であるタイトジャンクション構造と、細胞内輸送経路であるトランスサイトーシス(※4)の調節によりコントロールされている。
- (※3)ミクログリア
- 脳内に存在するグリア細胞の一つで、脳内での免疫担当細胞として働き、有害な物質や老廃物などを取り除く作用を持つ。正常な脳においては神経細胞の情報伝達を行う場所(シナプス)や血管内皮細胞と接触し、適切な脳機能の維持に働く。炎症時には活性化状態となり、炎症をさらに誘発するサイトカインを産生したり、有害な物質や細菌、ダメージを受けた細胞などの除去を行う。
- (※4)タイトジャンクション (密着結合)
- 細胞間接着構造の1つであり、細胞の隙間を分子が自由に通過することを防ぐ。脳血管内皮細胞ではクローディンやオクルディンなどの膜タンパク質とZO-1などの細胞内裏打ちタンパク質がタイトジャンクションに局在し、結合構造を構成している。
- (※5)トランスサイトーシス
- 細胞表面もしくは細胞膜上の受容体に結合した物質が細胞内に取り込まれ、細胞内小胞により反対側へ輸送され排出される。脳血管内皮細胞ではトランスサイトーシスを介した輸送は抑制されており、血液脳関門のバリアメカニズムの1つとなっている。
お問い合わせ先
研究に関するお問い合わせ先
功刀 浩 (くぬぎ ひろし)
帝京大学医学部精神神経科学講座主任教授
国立研究開発法人国立精神・神経医療研究センター神経研究所疾病研究第三部
客員研究員
〒173-8606 東京都板橋区加賀2-11-1
Tel:03-3964-1211(内線 34625) Fax:03-3961-8187
E-mail:hkunugi(a)med.teikyo-u.ac.jp
松野(鈴木) 仁美 (まつの(すずき) ひとみ)
国立研究開発法人 国立精神・神経医療研究センター神経研究所疾病研究第三部
客員研究員
〒187 -8502東京都小平市小川東町4-1-1
Tel:042-346-1714 Fax:042-346-1714
Email:hisuzuki(a)ncnp.go.jp
惣谷 和広 (そうや かずひろ)
佐賀大学医学部生体構造機能学講座神経生理学分野 准教授
国立研究開発法人 国立精神・神経医療研究センター神経研究所疾病研究第三部
客員研究員
〒849-8501佐賀県佐賀市鍋島5-1-1
Tel:0952-34-2271 Fax:0952-34-2013
Email:sohya(a)cc.saga-u.ac.jp
報道に関するお問い合わせ先
国立研究開発法人国立精神・神経医療研究センター
総務課広報室
〒187-8551 東京都小平市小川東町4-1-1
Tel:042-341-2711(代表) Fax:042-344-6745
Email:ncnp-kouhou(a)ncnp.go.jp
AMED事業に関するお問い合わせ先
国立研究開発法人日本医療研究開発機構
疾患基礎研究事業部疾患基礎研究課
脳科学研究戦略推進プログラム
〒100-0004 東京都千代田区大手町1-7-1 読売新聞ビル
Tel:03-6870-2286
Email:brain-pro(a)amed.go.jp
※Emailは上記アドレス(a)の部分を@に変えてご使用ください。
掲載日 令和4年6月27日
最終更新日 令和4年6月27日


