日本初の遺伝子組換え抗がんウイルス製品の実用化
 脳腫瘍に対するウイルス療法の医師主導治験で高い治療効果
脳腫瘍に対するウイルス療法の医師主導治験で高い治療効果
東京大学の藤堂具紀教授を中心とする研究グループは、がん治療用ヘルペスウイルスG47Δ デルタを用いて膠芽腫患者を対象にした医師主導治験を行っています。その中間解析の結果、1年生存割合が92.3%であり、標準治療の1年生存割合15%と比較して非常に高い治療効果が確認されました。
一方、G47Δ投与後に生じた副作用で最も頻度が高かったのは発熱であり、また、入院期間の延長が必要となった副作用も発熱のみであったことから、安全性の高い治療であることが示されています。本治験結果を基に、悪性神経膠腫を適応症としたG47Δの製造販売承認申請を行う予定です。
取り組み
神経膠腫は原発性脳腫瘍の約4分の1を占める代表的な悪性脳腫瘍であり、そのうち最も頻度が高く、また最も悪性度が高いのが膠芽腫です。手術後に放射線治療と化学療法を行ったとしても、生存期間中央値は診断から18カ月、5年生存率は10%程度で、治癒は極めて困難とされています。特に、最初の手術で全摘出できず放射線治療後にも腫瘍が残っている場合や再発した場合は、進行が早く有効な手段もないことから、新たな治療手段の開発が待ち望まれています。
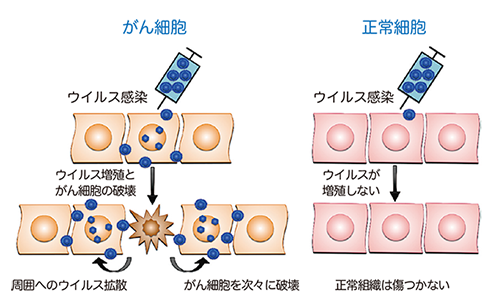
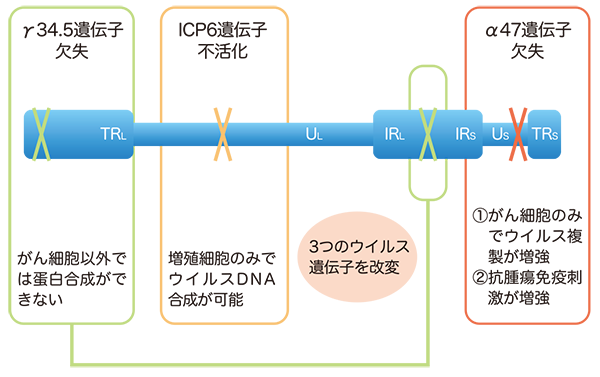
がんのウイルス療法とは、がん細胞のみで増えることができるウイルスを感染させ、ウイルスが直接がん細胞を破壊する治療法です(図1)。がん細胞だけで増えるように設計された遺伝子組換えウイルスは、がん細胞に感染するとすぐに増殖を開始し、その過程で感染したがん細胞を死滅させます。増殖したウイルスはさらに周囲に散らばって再びがん細胞に感染し、がん細胞を次々に破壊していきます。一方、正常細胞に感染した遺伝子組換えウイルスは増殖できないような仕組みを備えているため、正常組織は傷つきません。G47Δは単純ヘルペスウイルス1型の3つのウイルス遺伝子を改変して作製した、がん治療用の遺伝子組換えヘルペスウイルスです(図2)。
培養細胞や動物を用いた安全性や有効性の試験に加え、臨床試験に用いる治験薬の製造も東京大学医科学研究所内の施設で研究チームが自ら行い、世界に先駆けて日本で臨床開発を進めてきました。
成果
G47Δを初めてヒトに投与するfirst-in-man臨床試験は、2009年から、膠芽腫を対象とした臨床研究として東京大学で5年間実施され、脳腫瘍内への投与が安全であることが確認されました。そして今回、初期治療後に残存または再発した膠芽腫患者を対象として、G47Δの有効性を検討する医師主導治験(第Ⅱ相)を実施しました。
本治験は、放射線治療と化学療法(テモゾロミド)を行う標準治療に、G47Δを用いたウイルス療法を上乗せした場合に、生存期間が延長することを検討する治験デザインとなっています。30名の被験者を予定して2015年5月から被験者登録を開始しました。13名の被験者については、治療開始から1年経過した時点で中間解析を実施する治験実施計画となっており、2018年7月に中間解析が実施されました。その結果、主要評価項目である1年生存割合が92.3%を示し、標準治療の1年生存割合15%(他の複数の臨床試験結果から算出)に比べ格段に高く、G47Δの高い治療効果が確認されました。一方、中間解析の時点で、16名の被験者を対象に安全性の解析を行った結果、主な副作用は、発熱15名(93.8%)、嘔吐およびリンパ球数減少各8名(50.0%)、悪心7名(43.8%)であり、入院期間の延長が必要となった副作用も発熱2名(12.5%)のみでした。この中間解析の結果、本治験におけるG47Δの治療効果が認められたことを受けて、治験実施計画書に従い、独立したデータモニタリング委員会の勧告を経て、被験者登録を終了しました。
展望
本治験において、遺伝子組換えウイルスを用いたウイルス療法の有効性が、日本で初めて確認されました。本治験結果を基に、現在、悪性神経膠腫を適応症としたG47Δの製造販売承認申請の準備を行っています。
今回は、悪性神経膠腫を適応症としてG47Δの製造販売承認申請を行いますが、G47Δは他の固形がんに対しても有効であることが動物実験で示されていることから、今後さらなる適応拡大を目指します。
最終更新日 令和2年6月23日


