公募情報 令和8年度 「医療機器開発推進研究事業」に係る公募について
更新履歴
P-17の応募資格者(1)
(誤)(D)病院の研究開発部門、研究所等
↓
(正)(D)民間企業(スタートアップ企業に限る)の研究開発部門、研究所等。
基本情報
| 公募の段階 | 公募 |
|---|---|
| 開発フェーズ | 非臨床研究・前臨床研究,臨床試験,治験 |
| 分野 | 医療機器・ヘルスケアプロジェクト |
| 公募締め切り | 令和7年11月26日(水) 12時00分00秒【厳守】 ※締め切りに間に合わず不受理となるケースが発生していますので、余裕を持った対応をお願いします。特にe-Radの新規利用者は、研究機関/研究者の新規登録手続も必要であり、これらに要する日数も考慮の上、早めの対応をお願いします。 |
| お問い合わせ先 |
|
公募内容
国立研究開発法人日本医療研究開発機構では、令和8年度「医療機器開発推進研究事業」を実施する大学・企業等を以下の要領で広く募集します。
令和7年度公募より、スタートアップによる企業治験等および体外診断用医薬品の開発も支援の対象となります。詳しくは公募要領を参照ください。
本公募では次の研究開発課題について募集します。
| # | 分野、領域、テーマ等 | 研究開発費の規模 (間接経費を含まず) |
研究開発 実施予定期間 |
新規採択 課題予定数 |
|---|---|---|---|---|
| 1 | 医療負担の軽減に資する医療機器の実用化を目指す臨床研究・治験等 | a)臨床評価準備の場合 1課題あたり年間:15,000千円(上限) |
令和8年4月~ 令和9年度末 |
0~3課題程度 |
| b)探索的治験※1・臨床研究・性能評価試験※2の場合 1課題あたり年間:30,000千円(上限) |
令和8年4月~ 令和10年度末 |
|||
| c)検証的治験の場合※3 クラスⅡ 1課題あたり年間:46,000千円(上限) クラスⅢ・Ⅳ 1課題あたり年間:80,000千円(上限) |
||||
| 2 | 革新的医療機器の実用化を目指す臨床研究・治験等 | a)臨床評価準備の場合 <新規原材料のインプラントの場合※4> 1課題あたり年間:30,000千円(上限) <上記以外の場合> 1課題あたり年間:15,000千円(上限) |
令和8年4月~ 令和9年度末 |
<治療用> 0~3課題程度 <診断用> 0~3課題程度 |
| b)探索的治験※1・臨床研究・性能評価試験※2の場合 1課題あたり年間:30,000千円(上限) |
令和8年4月~ 令和10年度末 |
|||
| c)検証的治験の場合※3 クラスⅡ 1課題あたり年間:46,000千円(上限) クラスⅢ・Ⅳ 1課題あたり年間:80,000千円(上限) |
||||
| 3 | 小児用医療機器の実用化を目指す臨床研究・治験等 | a)臨床評価準備の場合 1課題あたり年間:15,000千円(上限) |
令和8年4月~ 令和9年度末 |
0~3課題程度 |
| b)探索的治験※1・臨床研究・性能評価試験※2の場合 1課題あたり年間:46,000千円(上限) |
<SaMD> 令和8年4月~ 令和10年度末 <上記以外> 令和8年4月~ 令和12年度末 |
|||
| c)検証的治験の場合※3 クラスⅡ 1課題あたり年間:60,000千円(上限) クラスⅢ・Ⅳ 1課題あたり年間:80,000千円(上限) |
||||
| 4 | 高齢者向け・女性の健康/疾病向けまたは在宅医療分野の推進に資する医療機器の実用化を目指す臨床研究・治験等 | a)臨床評価準備の場合 1課題あたり年間:15,000千円(上限) |
令和8年4月~ 令和9年度末 |
0~3課題程度 |
| b)探索的治験※1・臨床研究・性能評価試験※2の場合 1課題あたり年間:30,000千円(上限) |
令和8年4月~ 令和10年度末 |
|||
| c)検証的治験の場合※3 クラスⅡ 1課題あたり年間:46,000千円(上限) クラスⅢ・Ⅳ 1課題あたり年間:80,000千円(上限) |
||||
| 5 | 疾患登録システム(患者レジストリ)を活用した医療機器の実用化を目指す研究等 | a)臨床評価準備の場合 1課題あたり年間:15,000千円(上限) |
令和8年4月~ 令和9年度末 |
0~3課題程度 |
| b)既存のレジストリデータを用いる場合※5 1課題あたり年間:30,000千円(上限) |
令和8年4月~ 令和10年度末 |
|||
| c)薬機法申請に資するレジストリを構築する場合※6 クラスⅡ 1課題あたり年間:46,000千円(上限) クラスⅢ・Ⅳ 1課題あたり年間:80,000千円(上限) |
||||
| 6 | 医療ニーズの高い体外診断用医薬品の開発 | 1課題あたり年間:15,000千円(上限) | 令和8年4月~ 令和10年度末 |
0~3課題程度 |
分野1~4:
(分野3の予算については、上記表を参照すること)
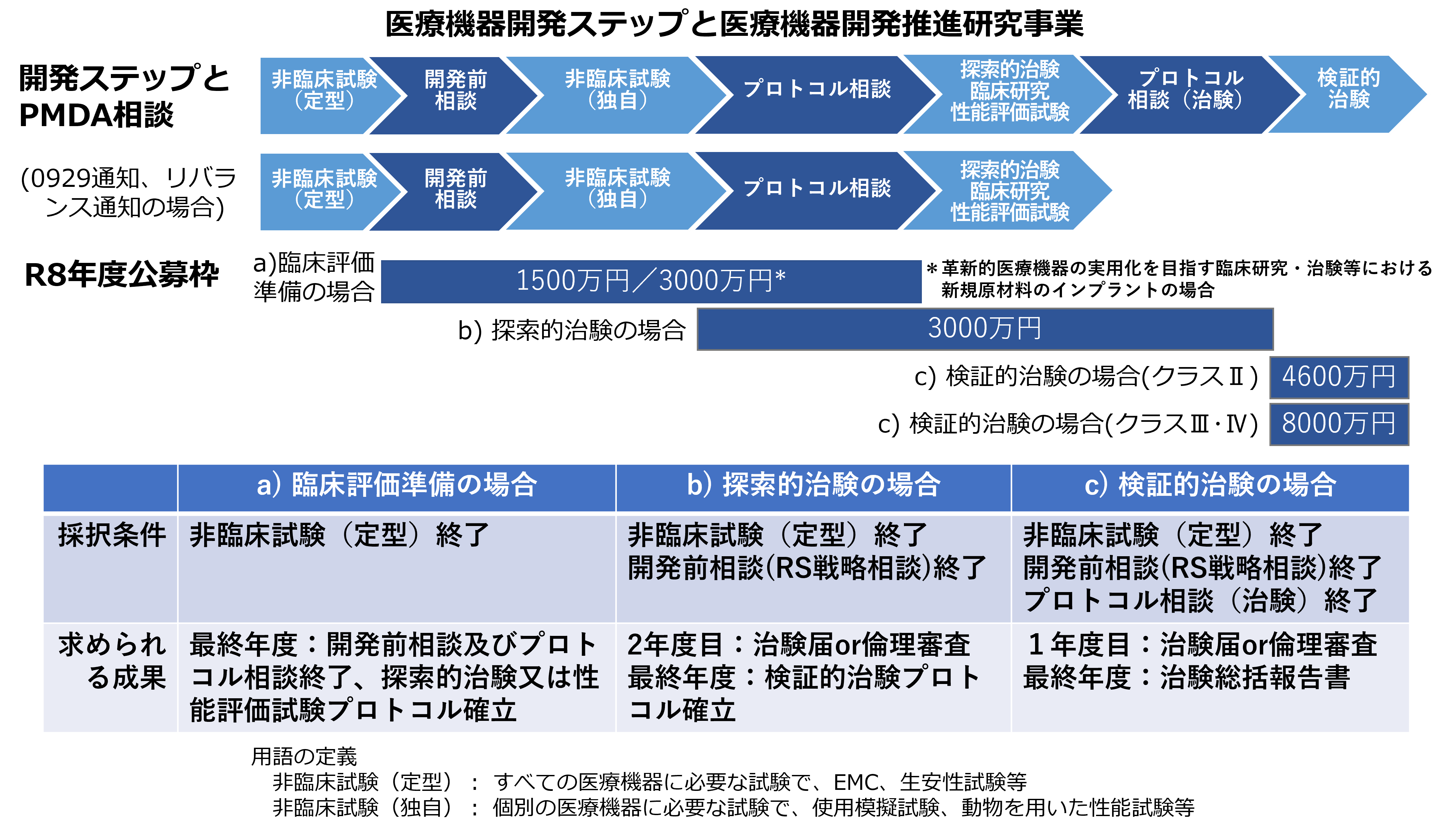
※1 探索的治験の場合は、PMDA開発前相談(RS戦略相談)を終了している研究を対象とする。
※2 性能評価試験の場合とは、「追加的な侵襲・介入を伴わない既存の医用画像データ等を用いた診断用医療機器の性能評価試験の取扱いについて」(令和3年9月29日付薬生機審発0929第1号)等に基づき、治験を実施せずに医療機器の評価を行い、医療機器製造販売業者への導出を目指す研究開発提案を指す。
※3 検証的治験の場合は、PMDAプロトコル相談(治験)を終了し、検証的治験プロトコルについてPMDAと合意済みの研究を対象とする。
※4 新規原材料のインプラントの場合とは、既承認/認証品と異なる、生物学的安全性試験による評価が求められる、新たな原材料を使用した「組織、骨または血管に埋め込まれる医療機器」の医療機器製造販売業者への導出を目指す研究開発提案を指す。
分野5:

※5 既存のレジストリデータを用いる場合とは、PMDAが実施する「レジストリ信頼性調査相談」及び「臨床試験要否相談」でPMDAと合意した内容を元に、後ろ向きに個別の医療機器の評価を行い、医療機器製造販売業者への導出を目指す研究開発提案、もしくは「追加的な侵襲・介入を伴わない既存の医用画像データ等を用いた診断用医療機器の性能評価試験の取扱いについて」(令和3年9月29日付薬生機審発0929第1号)等に基づき、医療機器の性能評価を行い、医療機器製造販売業者への導出を目指す研究開発提案を指す。
※6 薬機法申請に資するレジストリを構築する場合とは、提案前にPMDAと合意した内容(「レジストリ活用相談」及び「臨床試験要否相談」)を元に、研究開発期間中に薬機法申請に資するレジストリを構築し、医療機器製造販売業者への導出を目指す研究開発提案を指す。
- 詳細については公募要領をご参照ください。
事業概要
本研究事業は、国民により安全な医療技術を早期に提供することを目的として、日本で生み出された基礎研究の成果を、「医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律(以下、薬機法)」にもとづく医療機器及び体外診断用医薬品の承認に繋げるため、実用化への見込みが高く、科学性及び倫理性が十分に担保され得る質の高い治験・臨床研究等を推進します。
事業の案内ページ
応募資格者
本事業の応募資格者は、公募要領で定める条件を満たす機関に所属する者で、応募に係る研究開発課題について、研究開発実施計画の策定や成果の取りまとめ等の責任を担う能力を有する研究者(研究開発代表者)とします。
公募期間
※締め切りに間に合わず不受理となるケースが発生していますので、余裕を持った対応をお願いします。特にe-Radの新規利用者は、研究機関/研究者の新規登録手続も必要であり、これらに要する日数も考慮の上、早めの対応をお願いします。
AMEDではe-Radに登録された研究提案情報をダウンロードして評価システムに組み入れています。提案書の記載情報とe-Radへの入力情報に齟齬がないよう、提案前に双方の記載内容を十分確認してください。
ヒアリング日程
令和8年1月19日(月)、令和8年1月20日(火)、令和8年1月23日(金)(予定)
※ヒアリング日の指定はできません。こちらからの指定日となりますので、ご承知おきください。
公募説明会
当該委託事業の内容、応募に係る具体的な手続き等の説明会を次の通り実施します。
応募にあたっては公募説明会への出席は義務ではありません。
出席希望の企業等は、所属機関名、出席者氏名、出席者の連絡先(電話、電子メールアドレス)を2025年10月31日(金)正午までに電子メールで医療機器研究開発課担当者(med-device"AT"amed.go.jp)までご連絡下さい。(様式は問いません。)
※E-mailは上記アドレス“AT”の部分を@に変えてください。
日時:2025年11月4日(火)10時30分~11時30分(オンライン開催)
公募説明会を開催しました、説明会の資料を下記に掲載いたします。
応募方法
AMEDホームページより提案書類の様式等、必要な資料をダウンロードの上、公募要領に従って研究開発提案書等を作成の上、e-Radよりご提出ください。
- 応募にあたっては研究開発代表者および研究開発分担者が所属する研究機関がe-Radに登録されていることが必要となります。登録手続きに日数を要する場合がありますので、2週間以上の余裕をもって登録手続きをしてください。
- 全ての研究開発提案書類等について、公募期間を過ぎた場合には一切受理出来ませんのでご注意ください。
詳細については、公募要領およびe-Radポータルサイトを参照してください。
応募先
資料
資料
関連リンク
掲載日 令和7年10月29日
最終更新日 令和7年11月18日


