プレスリリース ゲノム編集のための新たな「はさみ」―立体構造にもとづくCRISPR-Cas9の改変―
プレスリリース
東京大学大学院理学系研究科・理学部
国立研究開発法人日本医療研究開発機構
発表者
西増 弘志(東京大学理学系研究科生物科学専攻 助教)
石谷 隆一郎(東京大学理学系研究科生物科学専攻 准教授)
Feng Zhang(Massachusetts Institute of Technology Assistant professor/Broad Institute of MIT and Harvard Core Member)
濡木 理(東京大学理学系研究科生物科学専攻 教授)
発表のポイント
- ゲノム編集(注1)に利用されるCRISPR-Cas9(注2)の結晶構造を解明した。
- Cas9の分子構造を改変し、新規のゲノム編集ツールを開発した。
- CRISPR-Cas9を利用したゲノム編集の効率化が期待される。
発表概要
発表内容
地球上のあらゆる生物はゲノムDNAの塩基配列を生命の設計図として利用しています。近年、ゲノムDNAの塩基配列を人為的に改変するゲノム編集技術が開発され、遺伝子の機能を調べるための実験手法として生命科学研究に革新をもたらしました。さらに、ゲノム編集技術を用いた動植物の品種改良や遺伝子治療といった応用研究も世界中で精力的に進められています。ゲノム編集を行うためには、まず改変したい部分のDNA配列を切断し、細胞のもつDNA修復機構(注3)を利用する手法がよく用いられています。膨大なゲノムDNA(ヒトでは約30億塩基対)のなかから、目的の配列のみを選択的に切断することは技術的に困難とされてきましたが、2013年、CRISPR-Cas9とよばれるDNA切断酵素を利用することによりゲノムDNA中のねらった場所を正確に切断できることが報告され、効率的なゲノム編集が可能となりました。Cas9タンパク質はガイド鎖RNAと複合体を形成し、ガイド鎖RNAと相補的な2本鎖DNAを切断する機能をもつため、ガイド鎖RNAを交換することにより、さまざまな2本鎖DNAを選択的に切断することができます(図1)。しかし、Cas9が標的DNAを切断するには、PAM(注4)とよばれる特定の塩基配列が標的配列の近くに存在する必要があるため、標的配列には制約が存在するという問題点が残されていました。
今回、東京大学の濡木理教授らの研究グループは細菌Francisella novicidaに由来するCas9(FnCas9)に着目し、構造機能研究を行いました。機能解析の結果、FnCas9はNGGという塩基配列をPAMとして認識することが明らかになりました。次に、FnCas9-ガイド鎖RNA-標的DNA複合体の結晶構造を決定し、FnCas9がNGG PAMを認識する分子機構を明らかにしました(図2)。さらに、YGという塩基配列をPAMとして認識するFnCas9改変体を作り出し、マウス受精卵においてYG PAMをもつ標的配列のゲノム編集に成功しました(図3)。本研究結果は、CRISPR-Cas9機構のさらなる理解、および、ゲノム編集の効率化につながることが期待されます。
本研究は、文部科学省 (2014年度)・日本医療研究開発機構(AMED)(2015年度以降)革新的バイオ医薬品創出基盤技術開発事業「新規CRISPR-Cas9システムセットの開発とその医療応用」(研究代表者:濡木 理)、科学技術振興機構 戦略的創造研究推進事業(さきがけ)「立体構造にもとづく次世代ゲノム編集ツールの創出」(研究代表者:西増 弘志)、日本学術振興会 新学術領域研究「立体構造から理解するRNAタクソノミ」(研究代表者:西増 弘志)の支援を受けて行われました。
発表雑誌:
論文タイトル:Structure and Engineering of Francisella novicida Cas9
著者:Hisato Hirano1, Jonathan S. Gootenberg2, Takuro Horii3, Omar O.Abudayyeh2, Mika Kimura3, Patrick D. Hsu2, Takanori Nakane1, Ryuichiro Ishitani1, Izuho Hatada3, Feng Zhang2, Hiroshi Nishimasu1,4,*, Osamu Nureki1,*
1.東京大学大学院理学系研究科
2.Broad Institute of MIT and Harvard
3.群馬大学生体調節研究所ゲノム科学リソース分野
4.国立研究開発法人科学技術振興機構さきがけ
* 責任著者
DOI番号:10.1016/j.cell.2016.01.039
お問い合わせ先
研究に関すること
教授 濡木 理
Tel:03-5841-4392
E-mail:nureki“AT”bs.s.u-tokyo.ac.jp
報道に関すること
特任専門職員 武田加奈子、准教授・広報室副室長 横山広美
TEL:03-5841-8856
E-mail:kouhou“AT”adm.s.u-tokyo.ac.jp
国立研究開発法人日本医療研究開発機構(AMED)
経営企画部 企画・広報グループ
Tel:03-6870-2245
AMEDの事業に関すること
国立研究開発法人日本医療研究開発機構(AMED)
戦略推進部 医薬品研究課
革新的バイオ医薬品創出基盤技術開発事業担当
〒100-0004 東京都千代田区大手町1-7-1
Tel:03-6870-2219 Fax:03-6870-2244
※E-mailは上記アドレス“AT”の部分を@に変えてください。
用語解説
- 注1 ゲノム編集:
- 生命の設計図であるゲノムDNAの塩基配列を人為的に改変する技術。
- 注2 CRISPR-Cas9(clustered regularly interspaced short palindromic repeats / CRISPR associated proteins):
- 原核生物のもつ獲得免疫機構。ウイルスやプラスミドなどの外来核酸に対する防御機構として働く。原核生物に感染した外来核酸は断片化され、原核生物のゲノムDNA(CRISPR領域)に取り込まれる。CRISPR領域からガイド鎖RNAが転写され、Cas9タンパク質と複合体を形成し、ガイド鎖RNA中のガイド配列と相補的な2本鎖DNAを特異的に切断する。ガイド配列は過去に感染した外来核酸に由来するため、Cas9-ガイド鎖RNA複合体は外来核酸からの二次感染を防ぐ役割をもつ。Cas9-ガイド鎖RNA複合体をCRISPR-Cas9とよぶこともある。
- 注3 DNA修復機構:
- 塩基の変異や2本鎖DNA切断を受けたゲノムDNAを修復する分子機構。2本鎖DNA中の切断部位は、非相同末端結合(NHEJ)や相同組換え(HR)とよばれる分子機構により修復される。NHEJでは、切断部位が直接結合することにより2本鎖DNA切断が修復される。修復時にDNA配列の欠失や挿入が生じることがある。HRでは、切断部位と相同な配列をもつ2本鎖DNAをコピーすることにより2本鎖DNA切断が修復される。
- 注4 PAM:
- Cas9によるDNA切断に必要な特定の塩基配列。標的とするDNA配列の近傍に存在する。DNAの4種類の塩基(ATGC)のうち、どれでもよい場合、「N」と表す。TまたはCの場合、「Y」と表す。
添付資料
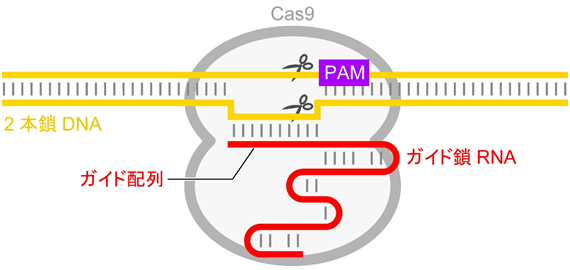
図1 CRISPR-Cas9によるDNA切断機構
Cas9はガイド鎖RNAと複合体を形成し、ガイド配列と相補的な2本鎖DNAを見つけ出し切断する。ガイド配列を変更することにより、標的DNA配列を自在に変更することができる。DNAの切断には、ガイド鎖RNAと標的DNAの間の配列相補性に加え、標的配列近傍のPAM配列が必要である。
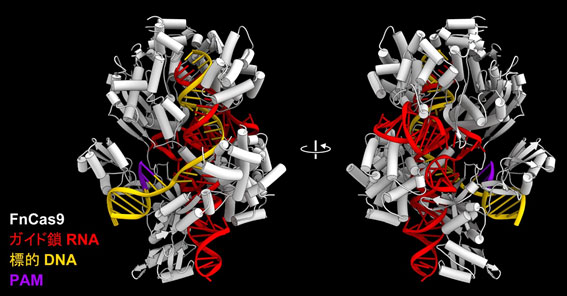
図2 FnCas9-ガイド鎖RNA-標的DNAの結晶構造
FnCas9、ガイド鎖RNA、標的DNAを白、赤、黄色で示した。PAMを紫色で示した。
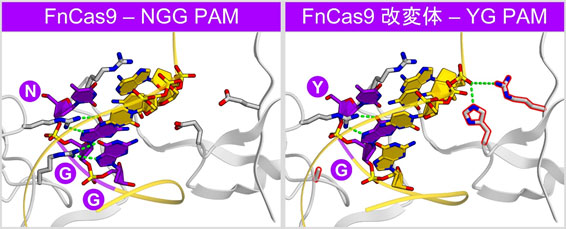
図3 結晶構造にもとづくFnCas9の改変
PAMの近くに位置するアミノ酸残基を変異させ、YG PAMを認識するFnCas9改変体を作製した。
関連リンク
掲載日 平成28年2月12日
最終更新日 平成28年2月12日


