プレスリリース ゲノム編集のための「小さなはさみ」のかたち―小型CRISPR-Cas9の立体構造を解明―
プレスリリース
国立研究開発法人日本医療研究開発機構
発表者
石谷 隆一郎(東京大学理学系研究科生物科学専攻 准教授)
Feng Zhang(MIT Assistant professor/Broad Institute of MIT and Harvard Core Member)
濡木 理(東京大学理学系研究科生物科学専攻 教授)
発表のポイント
- ゲノム編集(注1)に利用される小型CRISPR-Cas9(注2)の結晶構造を解明した。
- 本研究の成果によりゲノム編集の効率化・高度化が期待される。
発表概要
近年、生命の設計図であるゲノム情報(ゲノムDNAの塩基配列)を書き換える「ゲノム編集」技術に注目が集まっています。ゲノム編集は遺伝子の機能を調べるための新たな研究手法として生命科学分野に革命をもたらしました。さらに、動植物の品種改良、病気の治療を目指した応用研究も始まっています。ゲノム編集には化膿レンサ球菌(Streptococcus pyogenes)のもつCas9(SpCas9)とよばれるタンパク質が利用されていますが、分子のサイズが大きいため細胞への導入効率が低いという問題点が残されていました。一方、最近の研究から、黄色ブドウ球菌(Staphylococcus aureus)のもつCas9(SaCas9)は分子のサイズが小さく細胞への導入効率が高いことが明らかになっていました。しかし、SaCas9がはたらくしくみはよくわかっていませんでした。
今回、東京大学大学院理学系研究科の西増 弘志 助教、石谷 隆一郎 准教授、濡木 理 教授らのグループは、MITのFeng Zhang 博士のグループとの共同研究により、SaCas9の分子構造を決定し、そのはたらくしくみを原子レベルで解明しました。本研究の成果はゲノム編集のさらなる効率化・高度化につながることが期待されます。
発表内容
生命の設計図であるゲノム情報(ゲノムDNAの塩基配列)の書き換えは長い間、夢の技術と考えられてきました。しかし、2012年のCas9タンパク質の発見により、ゲノム情報の書き換えは、もはやSFの世界の話ではなく、日常的に用いられる研究手法として広く普及するまでになっています。Cas9はガイド鎖RNAと複合体を形成し、DNAを切断する「はさみ」としてはたらきます(図1)。ガイド鎖RNAはCas9をゲノムDNAの特定の場所へと誘導する「案内役」としてはたらきます。したがって、ガイド鎖RNAを交換することにより、ゲノムDNAの任意の場所を切断することができます。ゲノムDNA中の切断部位は細胞のもつ修復機構によって修復されますが、この過程においてDNAの塩基配列に変異が起こるとゲノム情報が改変されます。このようなゲノム情報の書き換え技術は「ゲノム編集」とよばれ、現在最も注目されている科学技術のひとつとなっています。
ゲノム編集には化膿レンサ球菌(Streptococcus pyogenes)のもつCas9(SpCas9)が利用されていますが、分子のサイズが大きいため細胞への導入効率が低いという問題点が残されていました。一方、最近の研究から、黄色ブドウ球菌(Staphylococcus aureus)のもつCas9(SaCas9)はSpCas9よりも分子のサイズが小さく細胞への導入効率が高いことが明らかになっていました。しかし、小型のSaCas9がDNAを切断するしくみはわかっていませんでした。
今回、東京大学の濡木 理 教授らの研究グループは、SaCas9、ガイド鎖RNA、標的2本鎖DNAからなる複合体を結晶化し、大型放射光施設SPring-8(注3)においてX線回折実験を行い、その分子構造を解明しました(図2)。その結果、SaCas9がガイド鎖RNAと複合体を形成して、標的DNAを切断するしくみが原子レベルで明らかになりました。これまでに分子構造が明らかになっていたSpCas9と比較して、SaCas9は無駄の少ないスリムな構造をもっていることが明らかとなりました。さらに、分子構造をもとにSaCas9を改変し、ねらった遺伝子を活性化させる機能をもつCas9や薬剤によって切断活性を制御できるCas9の開発にも成功しました。本研究の成果は、CRISPR-Cas9を応用したゲノム編集技術のさらなる効率化・高度化につながることが期待されます。
本研究は、文部科学省(2014年度)・日本医療研究開発機構(AMED)(2015年度以降)革新的バイオ医薬品創出基盤技術開発事業「新規CRISPR-Cas9システムセットの開発とその医療応用」(研究代表者:濡木 理)、科学技術振興機構 戦略的創造研究推進事業(CREST)「炎症の慢性化機構の解明と制御に向けた基盤技術の創出」(研究代表者:濡木 理)、総合科学技術・イノベーション会議 戦略的イノベーション創造プログラム(SIP)「次世代農林水産業創造技術」、科学技術振興機構 戦略的創造研究推進事業(さきがけ)「立体構造にもとづく次世代ゲノム編集ツールの創出」(研究代表者:西増 弘志)、日本学術振興会 基盤研究(B)「RNAサイレンシングの分子機構の解明」(研究代表者:西増 弘志)、日本学術振興会 新学術領域研究「立体構造から理解するRNAタクソノミ」(研究代表者:西増 弘志)の支援を受けて行われました。
発表雑誌
- 雑誌名:
- 「Cell」(8月27日オンライン版公開予定)
- 論文タイトル:
- Crystal structure of Staphylococcus aureus Cas9
- 著者:
- Hiroshi Nishimasu1,2, Le Cong3, Winston X. Yan3, F. Ann Ran3, Bernd Zetsche3, Yinqing Li3, Arisa Kurabayashi1, Ryuichiro Ishitani1, Feng Zhang3,*, Osamu Nureki1,*
- 東京大学大学院理学系研究科
- 独立行政法人科学技術振興機構さきがけ
- Broad Institute of MIT and Harvard
- *責任著者
- DOI番号:
- 10.1016/j.cell.2015.08.007
お問い合わせ先
研究に関すること
教授 濡木 理
Tel: 03-5841-4392 E-mail: nureki“at”bs.s.u-tokyo.ac.jp
報道に関すること
特任専門職員 武田 加奈子、准教授・広報室副室長 横山 広美
TEL:03-5841-8856 E-mail:kouhou“at”adm.s.u-tokyo.ac.jp
AMEDの事業に関すること
日本医療研究開発機構 戦略推進部医薬品研究課
革新的バイオ医薬品創出基盤技術開発事業担当
〒100-0004 東京都千代田区大手町1-7-1
TEL:03-6870-2219 FAX:03-6870-2244
E-mail: kaku-bio27“at”amed.go.jp
※E-mailは上記アドレス“at”の部分を@に変えてください。
用語解説
- (注1)ゲノム編集:
- 生命の設計図であるゲノムDNAの塩基配列を改変する技術。CRISPR-Cas9を利用することにより迅速・簡便なゲノム編集が可能になった。
- (注2)CRISPR-Cas9:
- 微生物のもつ獲得免疫機構のひとつ。Cas9はCRISPR-Cas9機構にかかわるRNA依存性DNA分解酵素として2012年に発見された。Cas9はガイド鎖RNAと複合体を形成し、ガイド鎖RNAの一部(ガイド配列)と相補的な2本鎖DNAを切断する機能をもつ。Cas9タンパク質やCas9-ガイド鎖RNA複合体をCRISPR-Cas9とよぶこともある。
- (注3)SPring-8:
- 兵庫県の播磨科学公園都市にある世界最高クラスの大型放射光施設。
添付資料:
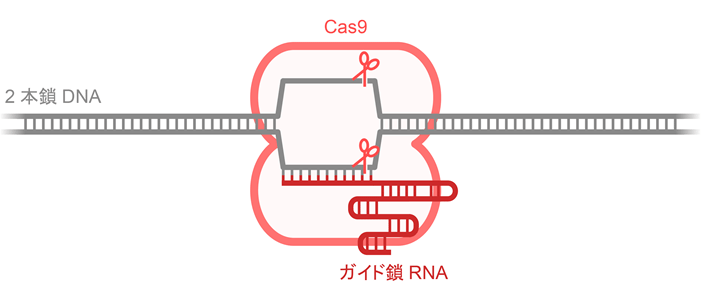
図1. CRISPR-Cas9を利用したゲノム編集
Cas9はガイド鎖RNAと複合体を形成し、ガイド鎖RNAと相補的な2本鎖DNAを切断する。ガイド鎖RNAは相補的なDNAと2重らせんを形成し、2本鎖DNAをほどく。Cas9はほどかれた2本のDNA鎖を切断する。ゲノムDNA中の切断部位が修復される過程でDNAの塩基配列に変異が起こるとゲノム情報が書き換えられる。
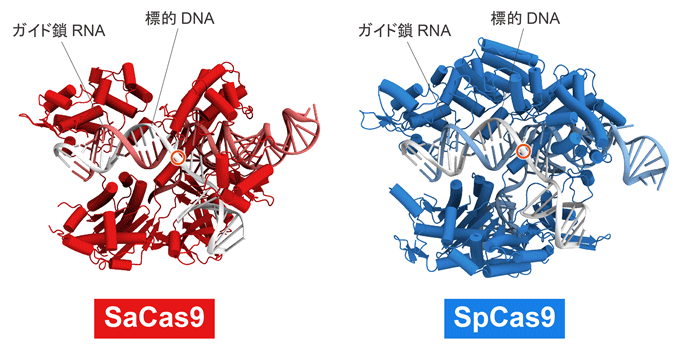
図2. SaCas9とSpCas9の分子構造の比較
SaCas9とSpCas9(PDB ID 4UN3)の結晶構造を示した。SpCas9に比べてSaCas9はスリムな構造をしていることがわかる。標的DNAの切断部位を赤丸で示した。比較のため、コンフォメーションの異なる領域(HNHドメイン)を省略した。
関連リンク
掲載日 平成27年8月28日
最終更新日 平成27年8月28日


