プレスリリース 酸化ストレスが糖尿病を引き起こすメカニズムを解明―酸化ストレス防御機構による肥満および糖尿病の改善作用―
プレスリリース
国立大学法人東北大学 東北メディカル・メガバンク機構
国立大学法人筑波大学
国立研究開発法人日本医療研究開発機構
研究概要
これまで、脳における代謝調節の破綻が肥満や糖尿病を引き起こすことが知られていましたが、その際に酸化ストレスが果たす役割は不明でした。今回の研究成果により、脳に酸化ストレスが蓄積すると、特に、全身の代謝調節に重要な視床下部領域の神経細胞数を減少させ、血糖降下ホルモンであるインスリンや肥満抑制ホルモンであるレプチンの作用を減弱させること、それを通して全身に肥満や糖尿病を引き起こすことがわかりました。さらに、脳の酸化ストレスを抑制することで、肥満や糖尿病を防ぐことが可能であることを明らかにしました(図1)。本研究成果から、脳の視床下部領域における酸化ストレス抑制が、糖尿病の治療標的として有用であることが理解されます。
この研究成果は2017年2月21日(日本時間22日午前2時)以降に米国科学雑誌「Cell Reports」のオンライン版で公開されます。
本研究の背景
本研究の成果
本研究では、セレノシステイン転移RNA(Trsp)遺伝子の視床下部における発現を特異的に低下させて、マウスにおいて視床下部領域で酸化ストレスを増加させることに成功しました。
このマウスの代謝様式を解析したところ、肥満と糖尿病を発症していることを発見しました。さらに、本マウスのホルモンの詳細な解析を行うと、インスリン抵抗性と肥満抑制ホルモンであるレプチンへの抵抗性が生じていました。すなわち、酸化ストレスが増加したマウスの脳では、視床下部領域での神経細胞死が増加した結果、代謝調節に重要なプロオピオメラノコルチン(POMC)陽性神経(※1)が減少していました。
ここまでの解析により、視床下部領域における酸化ストレスの増加が肥満や糖尿病を引き起こすことがわかりました。そこで、逆に、酸化ストレスを抑制することで、肥満や糖尿病が抑制できか否かを検討しました。この仮説を検証するため、酸化ストレスから我々の体を守るための転写因子(※2)であるNrf2に着目し、酸化ストレスに曝露したマウスの視床下部領域でNrf2を活性化したところ、酸化ストレスは低下し、肥満や糖尿病の発症を予防できることができました。
これらの結果から、視床下部領域における酸化ストレスが増加すると、神経細胞の細胞死が増加し、代謝調節に重要なPOMC陽性神経が減少して、肥満や糖尿病を引き起すことがわかりました。一方、転写因子Nrf2を活性化することで、視床下部領域の酸化ストレスを抑制し、肥満や糖尿病の発症が抑制できることも明らかになりました。
今後の展望
研究について
参加研究者名
本研究は、7研究施設に所属する10名の研究者による、共同研究として実施されました。
- 東北大学大学院医学系研究科 医化学分野
- 柳下 陽子、宇留野 晃、齋藤 律水、山本 雅之
- 東北大学 東北メディカル・メガバンク機構
- 三枝 大輔、山本 雅之
- 東北大学大学院医学系研究科 先端外科学分野
- 福富 俊明
- 筑波大学大学院医学医療系 解剖学・発生学分野
- 高橋 智
- 筑波大学 生命科学動物資源センター
- 杉山 文博
- 筑波大学 生命領域学際研究センター
- 深水 昭吉
- 中国医科大学
- Jingbo Pi
用語解説
- (※1)プロオピオメラノコルチン(POMC)陽性神経
- ホルモンの前駆物質であるプロオピオメラノコルチンを産生する神経細胞。
- (※2)転写因子
- DNAに結合して遺伝子の発現を制御するタンパク質。
参考図
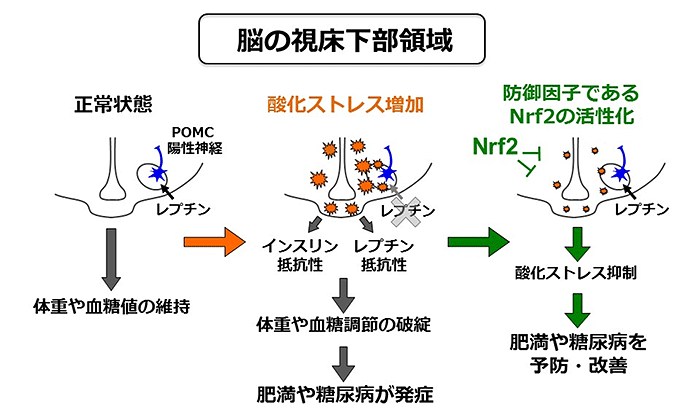 図1 脳視床下部領域の酸化ストレスによる肥満・糖尿病発症のメカニズムと視床下部領域のNrf2を標的とした肥満・糖尿病の発症予防および改善作用
図1 脳視床下部領域の酸化ストレスによる肥満・糖尿病発症のメカニズムと視床下部領域のNrf2を標的とした肥満・糖尿病の発症予防および改善作用
論文名
Nrf2 improves leptin and insulin resistance provoked by hypothalamic oxidative stress
Yoko Yagishita, Akira Uruno, Toshiaki Fukutomi, Ritsumi Saito, Daisuke Saigusa, Jingbo Pi, Akiyoshi Fukamizu, Fumihiro Sugiyama, Satoru Takahashi and Masayuki Yamamoto
「転写因子Nrf2は視床下部の酸化ストレスで引き起こされるレプチンおよびインスリン抵抗性を改善する」柳下陽子、宇留野晃、福富俊明、齋藤律水、三枝大輔、Jingbo Pi、深水昭吉、杉山文博、高橋智、山本雅之
掲載予定誌:Cell Reports
お問い合わせ先
研究に関すること
東北大学大学院医学系研究科 医化学分野
東北メディカル・メガバンク機構長
教授 山本 雅之(やまもと まさゆき)
電話番号:022-717-8084
Eメール:masiyamamoto”AT”med.tohoku.ac.jp
報道に関すること
東北大学東北メディカル・メガバンク機構
広報戦略室
大学院医学系研究科 医学部広報室
長神 風二(ながみ ふうじ)
電話番号:022-717-7908
ファックス:022-717-7923
Eメール:f-nagami”AT”med.tohoku.ac.jp
AMED事業に関すること
国立研究開発法人日本医療研究開発機構
戦略推進部 研究企画課
電話番号:03-6870-2224
FAX番号:03-6870-2243
Eメール:kenkyuk-ask”AT”amed.go.jp
※Eメールは上記アドレス”AT”の部分を@に変えてください。
掲載日 平成29年2月22日
最終更新日 平成29年2月22日


