細胞周期の間期(G1・S・G2)を3色で識別する技術の開発 -細胞周期可視化技術Fucciの多様化で再生医療などに貢献-
プレスリリース
革新的技術による脳機能ネットワークの全容解明プロジェクト
国立研究開発法人日本医療研究開発機構
要旨
理化学研究所(理研)脳科学総合研究センター細胞機能探索技術開発チームの宮脇敦史チームリーダーと阪上(沢野)朝子研究員らの共同研究グループ※は、細胞周期をより細かく色分けする新しい蛍光プローブ「Fucci(CA)」を開発しました。
細胞は、細胞周期[1]に沿って成長と分裂を実行することで増殖します。細胞周期の進行の制御はあらゆる生命科学において注目され、生物個体や細胞・組織培養系において、個々の細胞が細胞周期のどの位相にあるかを調べる技術が求められています。2008年に宮脇チームリーダーらが開発した細胞周期をリアルタイムに可視化する蛍光プローブ「Fucci(フーチ)」注1)は、世界中の研究者に利用されています。Fucciは細胞周期のG1期を赤の蛍光色に、S/G2/M期を緑の蛍光色に標識する蛍光プローブですが、S期とG2期を色分けすることはできませんでした。また、G1期標識の反応にはある程度の時間がかかるため、高速に増殖する細胞種の短いG1期は検出できないという問題点がありました。
今回、共同研究グループは、Fucci技術の作動原理である「細胞周期依存的ユビキチン[2]介在タンパク質分解」を多様に改変することで、Fucci(CA)を新たに開発しました。Fucci(CA)は、細胞周期の間期であるG1期・S期・G2期をそれぞれ赤・緑・黄の3色で識別します。通常の光学顕微鏡で蛍光シグナル分布を併せて観察すればM期も識別できる、すなわち四つの細胞周期全てを光学的に分離することができる技術です。実際にFucci(CA)を用いて、培養細胞の紫外線に対する感受性がS期に最も高いことを明らかにしました。さらに、Fucci(CA)は分裂直後からG1期を標識できるため、高速に増殖する未分化性マウスES細胞(胚性幹細胞)[3]の細胞周期においても、極端に短いG1期を含めて確実に検出できることが分かりました。
Fucci(CA)は哺乳類動物を扱うあらゆる生命科学分野で応用が可能です。がん、発生・再生研究だけでなく、動物脳における神経新生の検出、あるいは宇宙空間における細胞増殖の観察などにも適用が予定されています。今後、ヒトのES細胞(胚性幹細胞)やiPS細胞(人工多能性幹細胞)[3]を用いた再生医療および薬剤スクリーニングにおいての活躍も期待できます。
本研究は、米国の科学雑誌『Molecular Cell』(11月2日号)に掲載されるのに先立ち、オンライン版(10月26日付け:日本時間10月27日)に掲載されます。
本研究は、日本学術振興会 科学研究費補助金 新学術領域研究「レゾナンスバイオ」および「宇宙に生きる」、日本医療研究開発機構「革新的技術による脳機能ネットワークの全容解明プロジェクト」および「革新的先端研究開発支援事業(AMED-CREST)」、上原記念財団による支援を受けて行われました。
注1)2008年2月8日プレスリリース
※共同研究グループ
- 理化学研究所 脳科学総合研究センター
- 細胞機能探索技術開発チーム
- チームリーダー: 宮脇 敦史(みやわき あつし)
(光量子工学研究領域 生命光学技術研究チーム チームリーダー) - 研究員:阪上-沢野 朝子(さかうえ-さわの あさこ)
- 研究員:楊 正博(よう まさひろ)
- 研究員:小松 直貴(こまつ なおき)
- テクニカルスタッフⅠ:小暮 貴子(こぐれ たかこ)
- 光量子工学研究領域 生命光学技術研究チーム
- テクニカルスタッフ I:星田 哲志(ほしだ てつし)
- 京都大学大学院 医学研究科・病態生物医学
- 教授:松田 道行(まつだ みちゆき)
- 研究員:平塚 徹(ひらつか とおる)
1.背景
細胞周期は分裂期(M期)と間期から構成されます。M期は比較的短く一定で、この間に有糸分裂と細胞質分裂が起こるため、特徴的な形態を呈するM期の細胞は通常の光学顕微鏡の形態観察で同定できます。一方、細胞はほとんどの時間を間期で過ごし、その間にさまざまな活動を営みながらDNA複製(S期)を行います。S期とその前後のG1期、G2期は際立つ形態的相違がなく、通常の光学顕微鏡の形態観察では識別することができません。G1期、S期、G2期はそれぞれ、複製前休止期、DNA複製期、分裂前準備期と呼ばれます(図1)。
2008年に宮脇チームリーダーらは、細胞周期をリアルタイムに可視化する蛍光プローブFucci(Fluorescent ubiquitination-based cell cycle indicator、フーチ)を開発しました(図1左)。Fucciは、二つのE3ユビキチンリガーゼ[4]SCFSkp2とAPCCdh1が細胞周期依存的に交互に活性化することを利用しています。すなわち、SCFSkp2とAPCCdh1のそれぞれの基質hCdt1(human Cdt1)[5]とhGem(human Geminin)[6]が細胞周期依存的にユビキチン化[2]され分解することを利用しています。
実際には、ユビキチン修飾と分解に関わる領域hCdt1(30/120)およびhGem(1/110)に、赤色および緑色蛍光タンパク質を融合することで、G1期の細胞核を赤色に、S、G2、M期の細胞核を緑色に標識します。また、G1期からS期への移行(G1/S)に際して赤色蛍光タンパク質と緑色蛍光タンパク質の標識が一過的に重なり合う結果、「休止」モードから「増殖」モードへ移行しつつある細胞の核を黄色でハイライトすることになります。したがって、細胞増殖を高感度に検出すべきがん研究や発生・再生研究などの分野で、Fucciは盛んに用いられています。
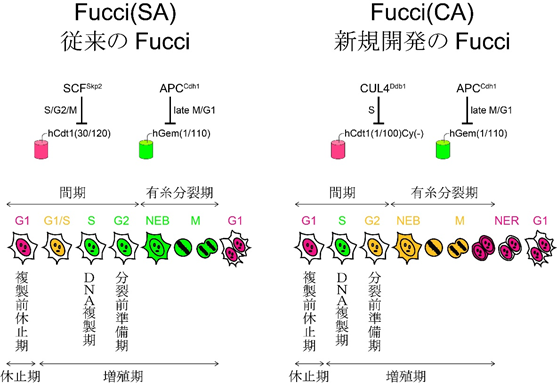 図1 細胞周期を可視化するFucci技術
図1 細胞周期を可視化するFucci技術細胞周期は有糸分裂期(M)、複製前休止期(G1)、DNA複製期(S)、分裂前準備期(G2)より構成される。
左: 従来のFucciのFucci(SA)は、休止期(G1)を赤色蛍光で、増殖期(S, G2, M)を緑色蛍光で識別する。またG1期からS期への移行(G1/S)、すなわち「休止」モードから「増殖」モードへ移行しつつある細胞の核を黄色でハイライトする。
右: 新しいFucci(CA)は、G1, S, G2期から成る“間期”について、G1期(赤色蛍光)、S期(緑色蛍光)、G2期(黄色蛍光)と個別に色分けすることができる。
2008年の発表以降、Fucci技術は細胞周期の進行を可視化する技術の世界標準として活躍しています。現在までにさまざまなFucci改変体が作製されていますが、いずれも蛍光タンパク質を入れ替えた色改変体でした。また、多くのFucci応用研究から次世代Fucciに対して以下の要請が生じてきました。
- G1期とS期のみならず、S期とG2期をも識別したい。
- 非常に短いG1期を確実に標識したい(従来のFucciは細胞分裂直後に一過的に無蛍光の時期があり、高速に分裂する細胞の短いG1期が見逃される場合がある)。
こうした要請に応えるには、根本的に異なる作動原理に基づくFucci改変体を開発する必要がありました。
2.研究手法と成果
共同研究グループは、hCdt1を基質とするE3ユビキチンリガーゼとして、SCFSkp2の代わりにCUL4Ddb1に着目しました。赤色蛍光タンパク質に融合する標的部位をhCdt1(30/120)からhCdt1(1/100)Cy(-)に変えることで、SCFSkp2ではなくCUL4Ddb1によってユビキチン化されるように仕組みました。分子設計と実証実験を繰り返し、新しいFucci改変体を完成させました(図1右)。これは二つのE3ユビキチンリガーゼCUL4Ddb1とAPCCdh1の活性をモニターするもので、その頭文字を取ってFucci(CA)と命名しました。Fucci(CA)プローブは、細胞周期の間期(G1期、S期、G2期)を赤・緑・黄の3色で識別することができます。さらにM期の始まりと終わりは、核膜の崩壊(NEB)と新生(NER)で決定することができ、それぞれ、黄色蛍光の核から細胞全体への広がりと赤色蛍光の細胞全体から核への局在化で同定することができます(図1右)。すなわちFucci(CA)を使うと、通常の蛍光顕微鏡を使って、全細胞周期(G1期、S期、G2期、M期)を識別することができます。ところで、上記命名法に従って、従来のFucciを、SCFSkp2とAPCCdh1の頭文字をとってFucci(SA)と呼ぶことにしました(図1左)。
Fucci(SA)およびFucci(CA)を安定に発現する培養細胞(HeLa細胞)を、長時間にわたりタイムラプス観察[7]してデータを解析し、SCFSkp2とCUL4Ddb1のE3ユビキチンリガーゼ活性の時間変化についての違いを確認することができました。増殖細胞を多数追跡しながら蛍光シグナルを記録するアルゴリズムを作成し、定量解析を行いました。その結果、SCFSkp2による分解は緩やかに、一方、CUL4Ddb1による分解は急に起こることが分りました(図2)。こうして解析を手動から自動に変えることで観察事象の数を格段に増やし、Fucci(SA)とFucci(CA)の細胞周期色分け性能の再現性を実証することができました。
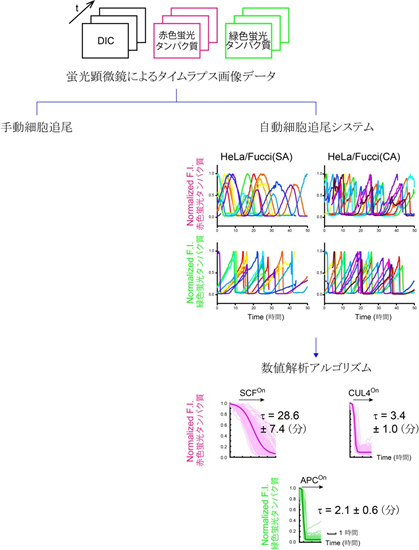 図2 Fucci画像データ処理システム
図2 Fucci画像データ処理システムFucciの分解/蓄積速度を定量解析するための自動細胞追尾システムおよび数値解析アルゴリズムを開発した。Fucci(CA)は、従来のFucci(SA)に比べて、G1/S移行の際の赤色蛍光プローブの分解速度が8倍以上速くなっている。
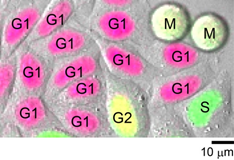 図3 Fucci(CA)を安定に発現するHeLa細胞の画像(蛍光+形態)
図3 Fucci(CA)を安定に発現するHeLa細胞の画像(蛍光+形態)インキュベーター顕微鏡(LCV100顕微鏡/オリンパス社製)により、3日~5日間にわたるライブイメージングを行い、プローブの性能評価を行った際のスナップショット画像。赤色蛍光画像、緑色蛍光画像、DIC(微分干渉画像)を重ね合わせることで、1枚の画像で個々の細胞の細胞周期の位相を判別することができる。
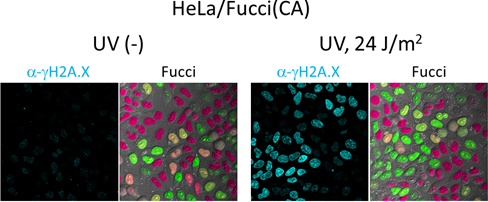 図4 UV感受性の細胞周期依存性
図4 UV感受性の細胞周期依存性左は紫外線(UV)を照射しなかった場合。右は24J/m2のUVを照射した場合で、DNA傷害のマーカーであるγH2A.X(抗γH2A.X抗体で検出)は、S期にある細胞(緑色蛍光)の核を特に強く染色した。すなわち、UV感受性はDNA複製の最中が最も高いことが分かった。
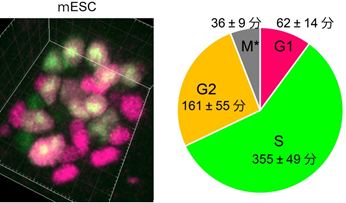 図5 未分化性を維持したマウス胚性幹細胞(ES細胞)の細胞周期
図5 未分化性を維持したマウス胚性幹細胞(ES細胞)の細胞周期
左: 未分化性のマウスES細胞(mESC)塊におけるFucci(CA)蛍光の3次元画像。赤はG1期、緑はS期、黄はG2期を示す。培養液にはLIF(白血病阻止因子:ES細胞の未分化性を維持する機能がある)が含まれている。
右: 未分化性のマウスES細胞の細胞周期は極めて短く、1サイクルが11時間程度であることが知られている。Fucci(CA)を用いることで、マウスES細胞のG1期がおよそ1時間程度であることが初めて確認された。
3.今後の期待
Fucci(CA)は、G1期、S期、G2期を3色で色分けできるので、細胞の状態がDNA複製の前と真中と後とでどう変わるのかという基本的問題に対して明快な解答を与えてくれます。一方、G1期からS期の移行、すなわち細胞が休止モードから増殖モードに推移する時間帯については、従来のFucci(SA)の方が高いシグナル比を示します。したがって、実験目的に合わせてプローブを選択する、あるいはFucci(CA)とFucci(SA)を相補的に使用することが望まれます。
今後、共同研究グループは、細胞周期の進行を駆動する「ユビキチン依存的タンパク質分解機構」を最大限に利用し、さらにFucci技術を多様に進化させることを計画しています。一例として、神経の損傷および変性の後に起こる再生を高感度に検出する技術の開発を進めています。
本研究成果は、哺乳類細胞の増殖と分化、がん化、老化、死などに関わるあらゆる研究分野で活用され、ヒトES細胞やiPS細胞を用いた再生医療および薬剤スクリーニングにおいて活躍すると期待できます。
参考に理化学研究所バイオリソースセンターから入手できるFucci関連のプラスミドおよび細胞を表に纏めました(表)。
| 材料名(プラスミド、細胞) | 基本情報 | 入手先 |
|---|---|---|
| mCherry-hCdt1(30/120) | DDBJ/EMBL/GenBank data-base [AB512478] | 遺伝子材料開発室 |
| mCherry-hCdt1(1/100)Cy(-) | [LC171208] | |
| mVenus-hGem(1/110) | [AB512479] | |
| tFucci(SA)2(mCherry, mVenus) | [LC192886] | |
| tFucci(SA)2.1 (mCherry, AmCyan) | [LC192887] | |
| tFucci(SA)2.2 (mCherry,m Turquoise) | [LC192888] | |
| tFucci(CA)2(mCherry, mVenus) | [LC212776] | |
| tFucci(CA)2.1(mCherry, AmCyan) | [LC212777] | |
| tFucci(CA)2.2(mCherry, mTurquoise) | [LC212778] | |
| HeLa/Fucci(CA)2(clone #3) | RIKEN, BRC [RCB4676] | 細胞材料開発室 |
| Home Page for Fucci related materials | ||
表
今回発表の主要プラスミド、細胞についての情報。tFucci (tandem Fucci)は2つのコンストラクトから成るFucciプローブをひとつの遺伝子上に連結したもの。プラスミドについては、理化学研究所バイオリソースセンター遺伝子材料開発室より、細胞については、同・細胞材料開発室より配布予定。
4.論文情報
- タイトル:
- Genetically-Encoded Tools for Optical Dissection of the Mammalian Cell Cycle.
- 著者名:
- Asako Sakaue-Sawano, Masahiro Yo, Naoki Komatsu, Toru Hiratsuka, Takako Kogure, Tetsushi Hoshida, Naoki Goshima, Michiyuki Matsuda, Hiroyuki Miyoshi, and *Atsushi Miyawaki.
- 雑誌:
- Molecular Cell
- DOI:
- 10.1016/j.molcel.2017.10.001
5.補足説明
- [1] 細胞周期:
- 細胞は、分裂を繰り返して増殖するが、この細胞分裂のサイクルを細胞周期と呼ぶ。細胞周期は、間期とM期に分けられる。分裂が起こるM(Mitosis)期と、DNAの複製が起こるS(Synthesis)期、それぞれの間をつなぐG1(Gap1)期、G2(Gap2)期からなり、サイクルはG1→S→G2→M→G1→…の順に進む。
- [2] ユビキチン、ユビチキン化:
- ユビキチンは76個のアミノ酸からなる小さなタンパク質である。タンパク質分解、DNA修復、転写調節、シグナル伝達などさまざまな生命現象に関わる。ユビキチン化とはタンパク質修飾の一種で、ユビキチンリガーゼなどの働きによりユビキチンが基質タンパク質に付加されること。通常、ユビキチンが複数連なったポリユビキチン鎖の修飾を受けたタンパク質は、選択的にプロテアソームで分解される。
- [3] ES細胞(胚性幹細胞)、iPS細胞(人工多能性幹細胞):
- 動物の初期胚が持つ、体を構成する全ての種類の体細胞へ分化する能力を多能性という。多能性を持ち、試験管内で培養して無限に増やすことができる細胞を多能性幹細胞という。ES細胞は、哺乳類の着床前胚(胚盤胞)に存在する内部細胞塊から作製された多能性幹細胞。iPS細胞は、皮膚細胞や血液細胞などの体細胞にOct3、Sox2、Klf4遺伝子などを導入して初期化し多能性を持たせ、人工的に作製した多能性幹細胞である。
- [4] E3ユビキチンリガーゼ:
- 基質となるタンパク質をユビキチン化するための三つの酵素の一つ。ユビキチン活性化酵素(E1)、ユビキチン結合酵素(E2)、ユビキチン転移酵素(ユビキチンリガーゼ)(E3)の働きにより、基質タンパク質がユビキチン化される。
- [5] hCdt1(human Cdt1):
- DNA 複製のライセンス化制御因子。真核細胞のゲノムは複数の染色体から構成されており、複数の複製開始点が存在している。それら複数の開始点全てから、1回の細胞周期で1回のみ複製が起こるように厳密に制御しているシステムが“ライセンス化”である。Cdt1は、G1期において複製開始点に局在しており、複製のライセンス化に非常に重要な役割を担っている。G1 期に発現量が高く、それ以外の時期にはユビキンチン-プロテアソーム系により分解されている。Cdt1はCdc10 dependent transcript 1 の略。。
- [6] hGem(human Geminin):
- DNA複製のライセンス化阻害因子。S期に突入し、一度複製が開始されたゲノムの複製開始地点に再びライセンス化因子が結合しないように機能することで、正常なDNA複製の監視役をしている。S期に発現量が増加し、複製と同時にCdt1と結合して、複製開始地点からCdt1を引きはがすことで機能阻害をすると考えられている。M期からG1期にかけては、ユビキンチン-プロテアソーム系により分解されるため、Cdt1によるライセンス化が可能になる。
- [7] タイムラプス観察:
- 経時的画像記録のこと。コンピュータ端末から顕微鏡とCCDカメラを制御するで、経時的に観察画像を取得・保存していく。それらの画像をつなぎ合わせて動画を作成すると、生きた細胞や組織の動態をコンピュータ上に再現することができる。
- [8] FACS技術:
- FACSはFluorescent activated cell sorterの略。ここでは、細胞に核染色剤を導入したものを対象に、細胞のDNA量を統計的に解析するのに用いた。
- [9] 抗体染色法:
- 抗原抗体反応を利用した、目的とするタンパク質(抗原)を特異的に検出する方法。蛍光色素で標識された2次抗体を用いて、抗原を間接的に蛍光色で染色し可視化することができる。
6.発表者・機関窓口
発表者 ※研究内容については発表者にお問い合わせ下さい
理化学研究所 脳科学総合研究センター
細胞機能探索技術開発チーム
チームリーダー 宮脇 敦史(みやわき あつし)
研究員 阪上-沢野 朝子(さかうえ-さわの あさこ)
TEL:048-467-5917 FAX:048-467-5924
E-mail:matsushi“AT”brain.riken.jp(宮脇)
機関窓口
理化学研究所 広報室 報道担当
TEL:048-467-9272 FAX:048-462-4715
E-mail:ex-press“AT”riken.jp
AMED事業について
日本医療研究開発機構 脳と心の研究課
〒100-0004 東京都千代田区大手町1-7-1
TEL:03-6870-2222 FAX:03-6870-2244
E-mail:brain-pm“AT”amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
掲載日 平成29年10月27日
最終更新日 平成29年10月27日


