プレスリリース 医師主導治験を経て、けいれん性発声障害の医療機器「チタンブリッジ」が薬事承認(先駆け指定制度薬事承認第一号)を取得
プレスリリース
国立大学法人熊本大学
国立研究開発法人日本医療研究開発機構
内転型けいれん性発声障害は、喉頭内部の声門閉鎖筋(声帯)が自分の意識とは関係なく収縮することで、発声時に声帯が閉じてしまう疾患です。声を出そうとすると、締め付けられ絞り出すような声になってしまう、途中で途切れるといった症状があります。本疾患は原因不明の難治性疾患で、社会生活が困難な状況が継続することにより、うつや引きこもり、自殺企図にまで発展する場合があります。
治療としてはボツリヌス毒素(ボツリヌムトキシン)の注射が一般的ですが、平均して2、3ヶ月で効果が切れてしまうため、継続して注射しなければならないという難点があります。一方で、チタンブリッジを用いた「甲状軟骨形成術2型」は、京都大学 一色信彦名誉教授により開発された手術法です。これは発声時に意図せず断続的に強く声帯筋が過閉鎖して症状が現れることに着目し、発声時に声門が強く内転(内側に閉じること)しても声帯が強く閉まらないように甲状軟骨(喉頭の軟骨)を縦に切開し、声帯と軟骨の付着部を軟骨ごと外側に広げて固定する手術手技で、半永久的な効果が期待できます(図1)。
手術に用いられるチタンブリッジは、世界に先駆けて開発されたわが国初の革新的な医療機器で、声門の過閉鎖を防止するのに適した医療材料として開発されたものです(図2)。患者さんの症状や甲状軟骨を広げる幅に応じて、ブリッジ部や羽部の適切なタイプを選択できるよう、サイズバリエーションが用意されています。
このチタンブリッジを用いた手術「甲状軟骨形成術2型」の有効性を確認するため、2006年8月から2011年9月にかけて、熊本大学耳鼻咽喉科で臨床研究が実施されました。対象となった内転型けいれん性発声障害患者21例のうち、評価可能な症例は17例でした。これらの17例についてのVHI-10スコア(声の障害の程度を測定するスコア)を測定したところ、術前平均値28.2で、術後1年経過時で4.9となり、その差は23.4とQOL向上の指標となるVHI-10スコアの改善が認められました。
この臨床研究における有効性、安全性の検討結果から、チタンブリッジの医療機器としての実用化に向け、治験を実施することとなりました。独立行政法人医薬品医療機器総合機構(PMDA)の薬事戦略相談の結果、対象疾患患者数が少なく、企業による治験実施が困難であることから、厚生労働省の難治性疾患等克服研究事業ならびに日本医療研究開発機構の難治性疾患実用化研究事業として、熊本大学医学部附属病院等による多施設共同医師主導治験を実施することとなり、2014年6月より治験実施準備を開始しました。
治験は2015年6月に開始しました。21例の52週間にわたる観察期間において、明確な発声障害の改善が認められ、重篤な有害事象、不具合の発現はありませんでした。2017年3月をもって最終被験者の観察を終え、2017年7月に治験を終了しました。
手術に用いるチタンブリッジについては、2016年2月、医療機器として先駆け審査指定制度審査対象品目第一号に指定され、2016年9月に希少疾病用医療機器の指定を受けました。その後、2017年6月に上述の医師主導治験の結果を以て企業による薬事申請を行った結果、薬事承認を得ることができました。
なお本製品は、先駆け審査指定制度における最初の承認品目です。
今回の薬事承認取得を受けて、今後、チタンブリッジを用いた甲状軟骨形成術2型手術が、安心・安全な治療法として内転型けいれん性発声障害患者さんのQOLに寄与することが期待されます。
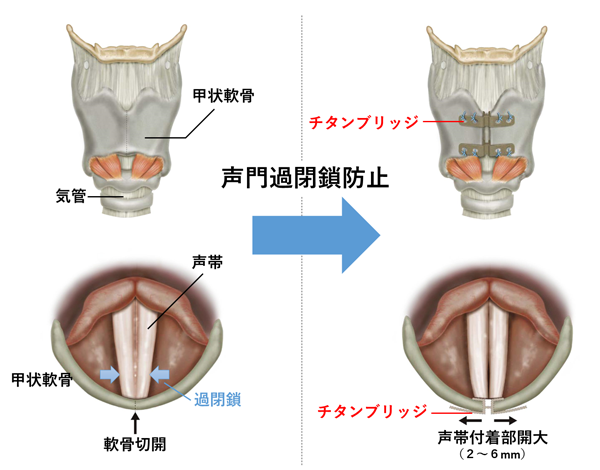
図1:チタンブリッジを用いた甲状軟骨形成術2型

図2:チタンブリッジ
治験概要
- 対象)
- 内転型痙攣性発声障害
- 目的)
- チタンブリッジを用いた甲状軟骨形成術2型の有効性及び安全性を検証する。
- デザイン)
- 非対照、非盲検試験
- 実施医療機関)
- 熊本大学医学部附属病院、北海道大学病院、横浜市立大学附属病院、京都大学医学部附属病院
- 目標症例数)
- 20例
- 治験期間)
- 同意所得から手術後 52 週間
- 主要評価項目)
- VHI-10(声の障害の自覚度)を用いて、術前と術後13週の差を比較
- 副次評価項目)
- 発声機能、音響分析等
- 安全性評価項目)
- 有害事象、不具合の発現頻度
医療機器詳細
甲状軟骨固定用器具「チタンブリッジ」 平成29年12月15日(金)薬事承認
申請者:ノーベルファーマ株式会社
[チタンブリッジ]は、発声時に声帯が強く内転しても声門が強く閉まらないように、甲状軟骨を開大維持するためのブリッジ部と、本品を甲状軟骨に縫合固定するための羽部からなるチタン製の蝶番型プレートである(図2)。患者の症状や甲状軟骨の大きさに応じて、ブリッジ部や羽部の適切なタイプを選択できるよう、サイズバリエーションが用意されている。
研究資金
- 厚生労働省科学研究費補助金 難治性疾患等克服研究事業(H26-委託(難)-一般-008)
- 日本医療研究開発機構 難治性疾患実用化研究事業 H27-28
研究関係者
- ・研究グループ
- 熊本大学医学部附属病院 耳鼻咽喉科頭頸部外科 講師 讃岐 徹治(治験調整医師、研究代表者)
(平成29年10月より名古屋市立大学大学院医学研究科へ異動)
熊本大学医学部附属病院 耳鼻咽喉科頭頸部外科 名誉教授 湯本 英二
北海道大学病院 耳鼻咽喉科頭頸部外科 助教 溝口 兼司
東京大学医学部附属病院 耳鼻咽喉科・聴覚音声外科 講師 二藤 隆春
横浜市立大学附属病院 耳鼻いんこう科 教授 折館 伸彦
横浜市立大学附属病院 耳鼻いんこう科 准教授 畠山 博充
京都大学医学部附属病院 耳鼻咽喉科頭頸部外科 講師 楯谷 一郎
京都大学医学部附属病院 臨床研究総合センター 助教 角 栄里子 - ・機器提供
- 株式会社若吉製作所(福井県鯖江市)
- ・指導・助言
- 京都大学 名誉教授 一色 信彦
お問い合わせ先
名古屋市立大学大学院医学研究科 耳鼻咽喉頭頸部外科
担当:讃岐 徹治
TEL:052-853-8256
E-mail:otostl"AT"gmail.com
AMED事業に関するお問い合わせ先
日本医療研究開発機構 戦略推進部 難病研究課
〒100-0004 東京都千代田区大手町1-7-1
TEL:03-6870-2223 FAX:03-6870-2243
E-mail:nambyo-info"AT"amed.go.jp
※E-mailは上記アドレス"AT"の部分を@に変えてください。
掲載日 平成29年12月18日
最終更新日 平成29年12月18日


