運動する細胞の進行方向を決める仕組みを解明―前側と後側を決める分子は互いに抑制し合う―
プレスリリース
理化学研究所
大阪大学
日本医療研究開発機構
理化学研究所(理研)生命機能科学研究センター細胞シグナル動態研究チームの松岡里実研究員と上田昌宏チームリーダー(大阪大学大学院生命機能研究科教授)の研究チームは、運動する細胞の前後方向が決まる仕組みの一端を明らかにしました。
本研究成果は、細胞極性[1]を決める基本原理を説明するとともに、細胞運動[2]を操作する技術への応用や、がん細胞が浸潤、転移する仕組みの理解につながると期待できます。
運動する細胞の細胞膜上では、進行方向に対して前側には脂質分子PIP3[3]が、後側にはその分解酵素であるPTEN[4]が、空間的に分離して存在しています。細胞が効率良く運動するには、細胞の前後領域が明確に区別される必要がありますが、PIP3とPTENの細胞膜上での分布がなぜ混じり合わないのかはよく分かっていませんでした。
今回、研究チームは、生きている細胞の中の1個の分子を観察する「1分子イメージング法[5]」を用いて、細胞の前後を決める分子の動きを解析しました。その結果、PIP3とPTENが互いに抑制し合う働きによって、細胞膜上での分布が混じり合わず、前後の領域の境界が明確になることが分かりました。この発見から、細胞の運動に方向性を与える酵素―基質システムの存在が明らかになりました。
本研究は、米国の科学雑誌『Nature Communications』オンライン版(10月26日付け:日本時間10月26日)に掲載されました。
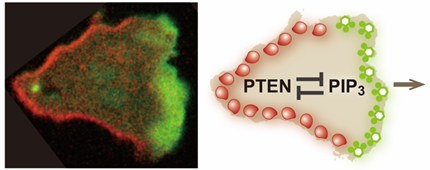
図 細胞膜上の2分子が細胞の前後を決める
- ※研究支援
- 本研究は、日本医療研究開発機構(AMED)「革新的先端研究開発支援事業(AMED-CREST)」の研究開発領域「画期的医薬品等の創出をめざす脂質の生理活性と機能の解明(研究開発総括:横山信治)」における研究課題「1分子・質量イメージング顕微鏡の開発と細胞膜機能解析(研究開発担当者:上田昌宏)」および日本学術振興会(JSPS)科学研究費補助金基盤研究C「細胞の前後極性のリポソーム内再構成(研究代表者:松岡里実)」による支援を受けて行われました。
背景
細胞の重要な機能の一つに細胞運動があります。例えば、けがをすると血液の中の白血球が体内を移動して傷口に集まります。白血球が血管の壁を這うように動くとき、細胞の進行方向側では細胞膜を押し出す力により仮足[6]が伸び、反対側では細胞を縮める力が働きます。このように、相反する力を細胞の両端で発生させる必要があることから、細胞が動き始めるときには、どちらが前でどちらが後ろかが明確に決まっていると考えられます。しかし、細胞の前後を決める仕組みは完全には分かっていません。
先行研究から、真核生物の細胞では、細胞膜上に存在する脂質分子PIP3とその分解酵素PTENの量によって、前と後ろが決まることが知られていました注1、2)。正常な細胞では、細胞膜は「PIP3が蓄積した領域(PIP3ドメイン)」と「PTENが蓄積した領域(PTENドメイン)」の二つの領域に明確に分けられ、細胞の前側にPIP3ドメインが、後側にPTENドメインができます。もしPIP3とPTENが互いに独立した仕組みで蓄積するならば、ニつのドメインが重なり合い、前側でも後側でもある場所ができる可能性があります。しかし、実際にはそのような現象は観察されず、PIP3ドメインとPTENドメインは細胞膜上で互いに分離しています。したがって、PIP3とPTEN の間には何らかの相互作用が働いて、それぞれの蓄積を排他的にしていると考えられますが、その仕組みは不明でした。
研究チームは仮説として、「PTENが増えればPIP3の蓄積が抑制され、PIP3が増えればPTENの蓄積が抑制される」のではないかと考えました。つまり、いったん後側になると周囲が前側にならないように、逆に、いったん前側になると周囲が後側にならないようにする仕組みがあれば、前後どちらともいえない場所ができるのを避けることができます。しかし、PIP3はPTENが触媒する酵素反応の基質であり、基質がたくさんあるのに酵素がその周囲に蓄積しないというのは直感に反します。また、通常の光学顕微鏡を用いた場合、観察できるのはPIP3ドメインやPTENドメインができた後の現象のため、二つのドメインができる過程で鍵となる分子の振る舞いを詳しく調べることは困難でした。
注1)Parent, C. A., Blacklock, B. J., Froehlich, W. M., Murphy, D. B. & Devreotes, P. N. G protein signaling events are activated at the leading edge of chemotactic cells. Cell 95, 81-91 (1998). 注2)Iijima, M. & Devreotes, P. Tumor suppressor PTEN mediates sensing of chemoattractant gradients. Cell 109, 599-610 (2002).
研究手法と成果
研究チームは、まず「PTENが増えるとPIP3の蓄積が抑制される(あるいは、PTENが減るとPIP3の蓄積が促進される)」かどうかを調べました(図1)。真核生物である細胞性粘菌[7]の細胞の中では、細胞性粘菌が元々持っているPTENは細胞膜に蓄積しますが、ヒトのPTENはこれに比べて蓄積量が少ないことが分かっています。そこで、遺伝子組換えにより、細胞性粘菌のPTENをヒトのPTENに交換したところ、細胞の前側になるPIP3ドメインが広がって(PIP3の蓄積が促進され)、PTENドメインとの境界が曖昧になりました。これによって運動方向が定まりにくくなり、運動速度が低下しました。つまり、十分な量のPTENが細胞膜に蓄積することでPIP3の細胞膜への蓄積を抑制し、前側領域だけに限定すると考えられます。
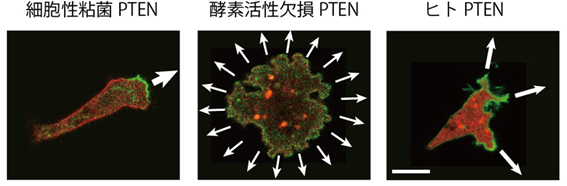
図1 PTENによるPIP3ドメインの制御
左:細胞性粘菌が元々持っているPTENを発現している細胞では、細胞膜(細胞の周囲の領域)に赤あるいは緑の蛍光が観察される。前側にあるPIP3ドメインと側面を含む後側にあるPTENドメインは、空間的に分離しており重ならない。 中:PTENの酵素活性を欠損した細胞では、PIP3ドメインが細胞膜全体に広がり、PTENドメインと重なる様子が観察された。 右:ヒトPTENを発現している細胞では、PIP3ドメインが広がってPTENドメインとの境界が曖昧になった。これにより前側領域が広がったため、細胞が前進しようとすると、運動方向が定まらない様子が観察された。
次に、これとは反対に「PIP3が増えるとPTENの蓄積が抑制される」かどうかを調べました。遺伝子組換えと薬剤処理を利用することで、顕微鏡観察の最中に細胞内のPIP3合成活性を操作することができます(図2)。PIP3合成活性の強さを徐々に大きくしていったところ、合成活性が低いときには、少し活性を上げてもPIP3量は変化しませんでしたが、合成活性が中程度のときには少し合成活性を上げただけで、PIP3が一挙に蓄積しPIP3ドメインが出現しました。さらに合成活性を上げていくと、PIP3ドメインの面積が広がりましたが、ドメイン内の各地点のPIP3蓄積量は変化しませんでした。一方でPTENは、PIP3が蓄積しなければ細胞膜に蓄積し、PIP3が蓄積するとその細胞膜領域では蓄積しなくなるという、PIP3とはちょうど反対の変化を示しました。
つまり、「PIP3は蓄積せずPTENが蓄積している状態」と「PIP3が蓄積しPTENは蓄積していない状態」が、スイッチが切り替わるように変化することが分かりました。こうした性質は双安定性[8]と呼ばれています。双安定性の成立には正常なPTENの機能が必要であり、ヒトPTENに交換した細胞では、スイッチのように切り替わらずPIP3がゆっくりと蓄積するようになりました。そのため、この細胞ではPIP3ドメインが広がって境界が曖昧になったと考えられます。このように、双安定性があることで前後が明確に分離し正常に運動できるようになることが示されました。
さらに、他の遺伝子操作による方法を用いてPIP3蓄積量を増やした実験でも、PTEN蓄積量の減少が確認できました。これらの結果から、PIP3はPTENの細胞膜への蓄積を抑制すると結論づけました。つまり、「PIP3とPTENは、細胞膜上での量を相互に抑制し合う関係(相互抑制関係)にある」ことが明らかになりました。
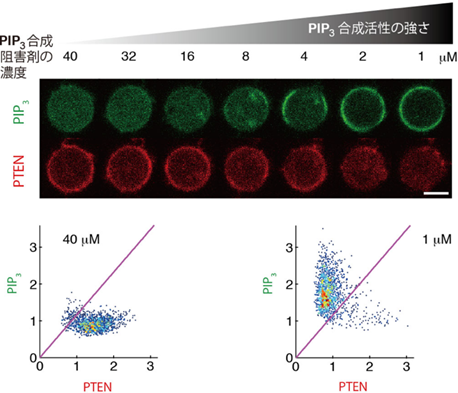
図2 PIP3とPTENの相互抑制関係
上:PIP3合成活性の操作実験。細胞内のPIP3合成活性を徐々に上げていき、細胞膜に蓄積するPIP3およびPTENを同時にイメージングした。PIP3合成活性が低いときには、少し活性を上げても(40μMから16μM)細胞膜のPIP3量は変化しない。合成活性が中程度のときに少し活性をあげると一挙にPIP3ドメインが出現し(16μMから4μM)、さらに上げるとPIP3ドメインが細胞膜全体に拡大した(4μMから2μM)。合成活性が高いときには、少し活性を上げてもPIP3量は変化しなかった(2μMから1μM)。一方でPTENは、PIP3が蓄積しなければ細胞膜に蓄積し(40μMから16μM)、PIP3が蓄積するとその細胞膜領域には蓄積しないようになった(4μMから1μM)。 下:PIP3/PTEN蓄積量の計測。PIP3合成活性の操作前後で、細胞膜上のPIP3(縦軸)およびPTEN(横軸)の蛍光強度を計測した。操作前(40μM)には細胞膜全体が高PTEN・低PIP3状態をとるが、操作後(1μM)には細胞膜全体が低PTEN・高PIP3状態になった。
次に、基質であるPIP3の蓄積がその分解酵素であるPTENの蓄積を抑制する仕組みを明らかにするために、1分子イメージング法を用いて細胞膜とPTENとの相互作用について定量的に解析しました(図3)。PTENの細胞膜結合時間を計測すると、PIP3が蓄積していなければ平均4.6秒であるのに対し、蓄積していると1.7秒にまで短縮されていました。また、PTENの細胞膜へ結合する頻度も、PIP3が蓄積していると半分に低下することが分かりました。
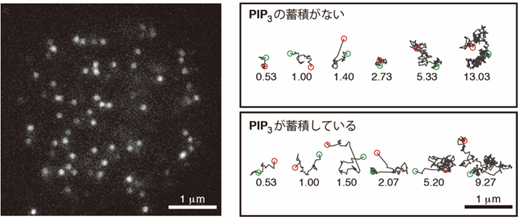
図3 細胞膜でのPTENの1分子イメージング解析
これらの結果は、PTENが細胞膜と結合するときの結合サイトをPIP3が抑制する可能性を示しています。これについて、1分子のPTENの動きをさらに詳しく解析して検証しました。PTENは、細胞膜に結合すると膜平面上を2次元的に拡散しますが、膜の脂質・タンパク質組成によって拡散する速さ(拡散係数[9])が異なります。研究チームは2013年に、独自に開発した1分子イメージングデータ統計解析法を用いて、PTENの拡散がどのように膜組成の影響を受けるかについて明らかにしていました注3)。同じように解析した結果、PTENがPIP3の分解を触媒する反応と共役して、結合サイトから外れやすくなっていることが分かりました(図4上左)。これは、PIP3の蓄積が高く酵素反応が起こりやすいと、PTENが細胞膜に留まりにくいことを意味します。このため、基質であるPIP3が酵素であるPTENの細胞膜への蓄積を抑制するようになると考えられます(図4上右、下)。
注3)Matsuoka, S., Shibata, T. & Ueda, M. Asymmetric PTEN distribution regulated by spatial heterogeneity in membrane-binding state transitions. PLoS Comput Biol. 9, e1002862 (2013).
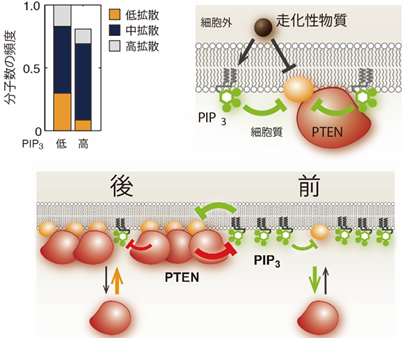
図4 PTENの拡散解析結果と導き出された仕組み
今後の期待
本研究において細胞運動のモデルとして用いた細胞性粘菌は、特定の化学物質に対する走化性[10]を示すことが知られています。今回明らかとなったPIP3とPTENのシステムは(図4)、この走化性物質に対する刺激でも働くことから、環境に応じて細胞の前後を決定し、生存に適した環境へと移動するための生存戦略を知る重要な手掛かりになります。また、こうした仕組みに則って細胞の運動を人為的に操作する方法を開発できれば、がん細胞や免疫細胞の運動性を制御する新たな治療法の開発につながると期待できます。
本研究で用いた手法は、細胞性粘菌だけではなく、哺乳類の培養細胞など他の細胞システムにおいても、膜分子の空間パターンが形成される仕組みの解明に応用することができ、多様な生物において細胞の極性が形成される普遍的な仕組みの理解に役立つと期待できます。
論文情報
- タイトル
- Mutual inhibition between PTEN and PIP3 generates bistability for polarity in motile cells
- 著者名
- Satomi Matsuoka, Masahiro Ueda
- 雑誌
- Nature Communications
- DOI
- 10.1038/s41467-018-06856-0
補足説明
- [1] 細胞極性
- 細胞の持つ方向性。運動する細胞の前―後、上皮細胞の頂端―基底のほか、出芽酵母や非対称分裂する細胞の極性などが知られている。それぞれの方向性は、細胞内で偏って存在する分子によって決まっている。
- [2] 細胞運動
- 細胞がエネルギーを使って行う運動。アメーバ細胞が細胞を変形させながら基質の上を這うように移動するアメーバ運動のほかに、バクテリアが鞭毛を動かして泳ぐように移動する鞭毛運動などがある。
- [3] PIP3
- リン脂質の一種である、フォスファチジルイノシトール3,4,5―三リン酸の略号。イノシトールリン脂質は、グリセリンを骨格とするグリセロリン脂質に分類される。グリセリンのC1位、C2位に脂肪酸がエステル結合し、C3位にリン酸を介してイノシトールが結合している。細胞内ではイノシトール環の3,4,5位の水酸基が7通りの組み合わせでリン酸化されており、それぞれが多様なシグナル伝達において重要な役割を担っている。PIP3はその全てがリン酸化されたもの。
- [4] PTEN
- PIP3を基質として認識して、イノシトール環の3位の脱リン酸化反応を触媒する酵素。PIP3は細胞増殖を促すシグナル伝達分子として働くため、PTEN遺伝子の不活化はPIP3の蓄積を招いてがん化をもたらす。遺伝子の変異が多くのガンで見つかる腫瘍抑制因子の一つである。
- [5] 1分子イメージング法
- 1分子の動きを顕微鏡とカメラを用いて可視化する技術。本研究では全反射蛍光顕微鏡と高感度CCDカメラを用いて、標的のタンパク質に結合させた色素が発する蛍光を1分子ごとに検出している。光がカバーガラスを通って試料との界面で全反射するときに試料側に染み出す性質を利用して、細胞膜近傍に存在する色素のみを励起するため、コントラストの高い画像を取得することができる。
- [6] 仮足
- 変形菌や白血球などの真核細胞に見られ、細胞が捕食、移動する際に突き出た部分。
- [7] 細胞性粘菌
- 和名キイロタマホコリカビ。真核生物であり原生生物界に属する。森林土壌などに生息する。生活環において単細胞期と多細胞期がある。栄養が豊富な環境では単細胞のアメーバとして増殖するが、栄養飢餓に陥るとアメーバ細胞が集合して多細胞期が開始される。単細胞アメーバは哺乳類の白血球細胞と同じようにアメーバ運動するため、モデル生物として古くから利用されてきた。
- [8] 双安定性
- システムがニつの安定な平衡状態を持つ性質。ほかに安定な状態がなく、どちらかの状態しかとれないので、平衡状態の間の切り替えが素早く起こる。このため、システムの振る舞いはスイッチのような特徴を示す。双安定性が生かされている例に、遺伝子のオン・オフなどがある。
- [9] 拡散係数
- 物質が拡散する速さの指標。水面にインクを滴下して十分に時間がたつと、均一な色の溶液になるが、これはインクの色素分子が水分子との間で、無数の無秩序な衝突を繰り返して拡散するためである。拡散する速さは、その分子の半径、拡散する溶媒の粘性、温度によって決まる。
- [10] 走化性
- 細胞が環境中の化学物質の濃度勾配に従って運動する性質。大腸菌はアミノ酸などの栄養分子に対して、好中球は細菌が産生するペプチドに対して、走化性を示すことが知られている。化学物質の濃度勾配は細胞膜上の受容体タンパク質によって検出され、細胞内シグナル伝達を経て、濃度が高い側へ運動する正の走化性、あるいは低い側へ運動する負の走化性を引き起こす。
発表者・機関窓口
発表者
理化学研究所 生命機能科学研究センター 細胞シグナル動態研究チーム
研究員 松岡 里実(まつおか さとみ)
チームリーダー 上田 昌宏(うえだ まさひろ)
(大阪大学大学院生命機能研究科 教授)
機関窓口
理化学研究所 生命機能科学研究センター センター長室 報道担当
山岸 敦(やまぎし あつし)
TEL:078-304-7138 FAX:078-304-7112
E-mail:ayamagishi[at]riken.jp
理化学研究所 広報室 報道担当
TEL:048-467-9272 FAX:048-462-4715
E-mail:ex-press[at]riken.jp
大阪大学 生命機能研究科庶務係
TEL:06-6879-4692
E-mail:seimei-syomu[at]office.osaka-u.ac.jp
AMED事業に関するお問い合わせ先
革新的先端研究開発支援事業(AMED-CREST)
日本医療研究開発機構(AMED) 基盤研究事業部 研究企画課
TEL:03-6870-2224
E-mail:kenkyuk-ask[at]amed.go.jp
※上記の[at]は@に置き換えてください。
掲載日 平成30年10月30日
最終更新日 平成30年10月30日


