プレスリリース ヒューマンオルガノイド技術による炎症・線維化病態の再現に成功!―脂肪性肝炎に対するオルガノイド創薬に期待―
プレスリリース
国立大学法人 東京医科歯科大学
国立大学法人 埼玉大学
国立研究開発法人 日本医療研究開発機構
ポイント
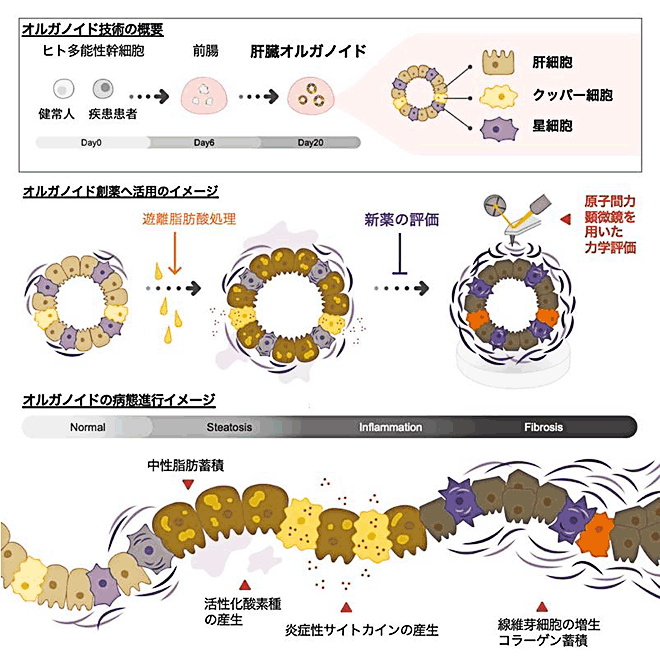
- 多能性幹細胞*1から、免疫系細胞を含む複数種類の細胞が含まれたヒト肝臓オルガノイド*2(ミニ肝臓)を創出するための新規培養技術の開発に成功しました。
- 患者数が多い脂肪性肝炎*3の特徴である脂質蓄積、炎症、線維化の病態変化を、ヒト肝臓オルガノイドにおいて生体外で再現できることを明らかにしました。
- 「オルガノイド創薬」という全く新たな概念に基づき、いまだ有効な薬剤が存在しない脂肪性肝炎などの新薬開発への応用が期待できます。
概要
東京医科歯科大学統合研究機構 先端医歯工学創成研究部門 創生医学コンソーシアムの武部貴則教授、大内梨江特任研究員らの研究グループは、埼玉大学大学院理工学研究科 ・吉川洋史教授らのグループと、シンシナティ小児病院との共同研究で、ヒト多能性幹細胞(iPS細胞やES細胞)から、炎症や線維化を担う複数種類の細胞を内包した複雑なヒト肝臓オルガノイド(ミニ肝臓)を創出することに成功しました。この新たな肝臓オルガノイド創出技術は、患者数が多い脂肪性肝炎の特徴である炎症や線維化を生体外で再現でき、さらには、治療に有効な新薬の評価に活用することができます。
この研究は、日本医療研究開発機構(AMED)再生医療実現拠点ネットワークプログラム「内胚葉オルガノイドの線維化誘導とメカノスクリーン体系の創生」ならびに肝炎等克服実用化研究事業「ゲノム付きNAFLD オルガノイドパネルを用いた革新創薬概念の実証」、科学技術振興機構 戦略的創造研究推進事業、文部科学省 科学研究費補助金、ならびにシンシナティ小児研究財団助成金の支援のもとでおこなわれたもので、その研究成果は、国際科学誌「Cell Metabolism」に、2019年5月30日午前11時(米国東部時間)にオンライン版で発表されます。
研究の背景
近年、日本においても、多量飲酒歴が無いにも関わらず肝臓に脂肪が蓄積してしまう非アルコール性の脂肪性肝疾患が急増しています。脂肪性肝疾患の中でも、脂肪性肝炎は、単純な脂肪肝から発展して、肝臓の炎症や線維化を伴う疾患で、しばしば肝硬変や肝がんを引き起こすことから、治療介入が必須です。日本を含めて世界的に有病率のさらなる増加が見込まれていますが、脂肪性肝炎の発症メカニズムには不明な点が多く、有効性の高い治療法が存在しないことが大きな問題となっています。脂肪性肝炎に関する従来の研究は、主にモデル動物を使って行われきましたが、ヒトの脂肪性肝炎病態を十分に再現できないために、ヒト病態の理解や治療効果の高い薬剤の開発には至っていません。このような背景から、炎症や線維化といった複雑な病態を再現可能なヒトの肝臓モデルへのニーズが高まっています。また、脂肪肝から脂肪性肝炎へ発展する進行度合いには大きな個人差があることが知られており、個々の患者の病態をモデル化できるような実験系の開発が世界的にも急務とされています。
研究成果の概要
近年、iPS細胞やES細胞といったヒトの多能性幹細胞から、「オルガノイド」と呼ばれる生体組織・器官に類似した立体構造を試験管内で創出する技術が、発生生物学や創薬研究に至るまで、幅広く活用されています。これまでに、研究グループはヒトiPS 細胞から血管系が付与された肝臓オルガノイドを創出する技術を世界に先駆けて開発してきました(Gray et al., Nature 2017; Takebe et al., Cell Stem Cell 2015; Takebe et al., Nature, 2013)。そこで本研究では、これまでのオルガノイド技術に欠けていた炎症を誘発する免疫系細胞 や線維化に関与する間質系細胞を内包した、新規の肝臓オルガノイドシステムを創出することによって、炎症や線維化といった脂肪性肝炎の病理的な特徴を再現することを試みました。
炎症や線維化を再現可能なヒト肝臓オルガノイドを創出するために、研究グループはヒト多能性幹細胞から、肝臓の主要な構成細胞である肝上皮細胞に加えて、炎症を惹起する肝臓常在性マクロファージであるクッパー細胞や線維化を誘導する肝星細胞などの、複数種類の細胞を同時に分化させる手法をとりました。すなわち、肝臓の起源である前腸内胚葉の形成、および、マクロファージの分化や肝星細胞の分化に重要なレチノイン酸シグナルに着目し、オルガノイドの形成初期にレチノイン酸を一過的に導入することで複数系譜の細胞を同時に創出する(共分化させる)手法を確立しました。各細胞種マーカーの発現解析や単一細胞トランスクリプトーム解析などを駆使した解析の結果、構築されたオルガノイドには、肝上皮細胞に加えて、クッパー細胞や肝星細胞に遺伝子発現プロファイルや細胞機能が極めて類似した細胞群が含まれていることが明らかになりました。このオルガノイドの培養手法によって、疾患特異的iPS細胞を含む11名の方から樹立したヒト多能性幹細胞から同様の肝臓オルガノイドが構築できることが確認され、本手法の肝臓オルガノイドは汎用性・再現性の極めて高いヒト肝臓モデルであると考えられます。
次に、ヒト肝臓オルガノイドに脂肪性肝炎の特徴である炎症や線維化を誘導するための培養条件を検討した結果、遊離脂肪酸であるオレイン酸を添加することにより、肝臓オルガノイド中に中性脂肪(トリグリセリド)が顕著に蓄積し(図)、その後、TNF-αやIL-8などの炎症性サイトカインの発現・分泌が上昇するとともに、線維化を示す病理的変化が起こることを見出しました。さらに興味深いことに、この線維化をよく反映する形で、肝臓オルガノイド自体の物理的な硬さも増加することが、原子間力顕微鏡を用いた解析から明らかになりました。以上の結果から、ヒト肝臓オルガノイドを用いることで、脂肪性肝炎の病態に重要な脂肪蓄積、炎症反応、線維化が試験管内で誘導できる可能性が示されました。
最後に、このヒト肝臓オルガノイドによる脂肪性肝炎モデルが臨床病態と相関することを検証するために、先天性の脂肪性肝炎を発症するリソソーム酸性リパーゼ欠損症(Wolman病)患者由来iPS細胞から肝臓オルガノイドを構築し、その表現型を解析しました。その結果、臨床病態と一致して、肝臓オルガノイド内に顕著な脂肪蓄積が観察され、炎症応答や線維化も健常者iPS 細胞由来肝臓オルガノイドよりも有意に促進されることが明らかになりました。さらに、非アルコール性脂肪性肝炎に対する臨床III 相試験薬であるオベチコール酸の下流標的であるFGF19 でWolman病患者iPS 細胞由来肝臓オルガノイドを処理すると、脂肪蓄積や線維化が抑制されることを見出しました。これらの結果から、本研究で開発したヒト肝臓オルガノイドによる脂肪性肝炎モデルは、先天性の病態を模倣可能であるとともに、オベチコール酸やFGF19などの開発中の新薬の薬効評価にも有用であることが示されました。
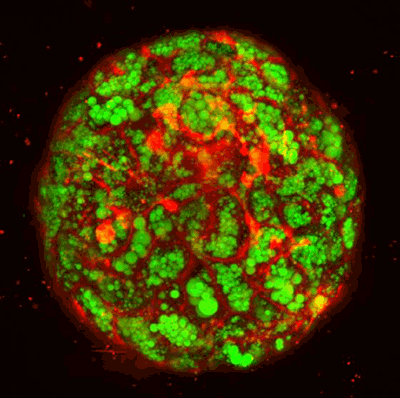
図 ヒト脂肪性肝炎オルガノイドの蛍光観察像
研究成果の意義
- 免疫系細胞が出現するオルガノイド技術を開発したことにより、さまざまな臓器の炎症・線維化の研究に類似の手法が有効になる可能性があります。
- 従来の動物モデルやオルガノイド培養技術では困難だった、患者数の多い脂肪性肝炎などの複雑なヒト疾患のメカニズムの理解が加速すると考えられます。
- ヒト脂肪性肝炎の患者病態の再現に優れている利点を活用し、今後、オルガノイドを用いた創薬スクリーニング(オルガノイド創薬)を通じて、治療に有効な新薬の開発が期待されます。
用語の説明
- *1多能性幹細胞
- 体内のあらゆる組織に分化できる能力(多能性)と無限の増殖能を持つ幹細胞の総称。胚盤胞より樹立される胚性幹(ES)細胞や、体細胞に特定因子を導入することにより樹立される、ES細胞に類似した人工多能性幹(iPS)細胞などが知られています。
- *2オルガノイド
- 生体内で存在する器官に類似した組織構造体のこと。近年盛んに研究が進んでいる技術領域であり、武部らも2013年、2015年、2017年にさまざまな臓器のオルガノイド(ミニ臓器)が作製可能であることをNature誌(Nature 499(7459):481-4, 2013)、Cell Stem Cell誌(Cell Stem Cell 16(5):556-65, 2015)、Cell Reports誌(Cell Reports 21:2661–2670, 2017)にそれぞれ報告しています。
- *3脂肪性肝炎
- さまざまな原因で、肝臓の細胞に中性脂肪が沈着して肝障害をきたす疾患の総称であり、特に、肥満者において肝臓内に過剰な中性脂肪の蓄積(脂肪肝)、炎症や線維化が認められる病態を有する非アルコール性脂肪肝炎(NASH:nonalcoholic steatohepatitis)が注目されている。NASHは今後も増加が見込まれる重要な疾患ですが、その診断方法や治療方法は未だ確立していません。
論文情報
- 掲載誌:
- Cell Metabolism
- 論文タイトル:
- Modeling Steatohepatitis in Human with Pluripotent Stem Cell-Derived Organoids
- 共著者一覧:
- Rie Ouchi, Shodai Togo, Masaki Kimura, Tadahiro Shinozawa, Masaru Koido, Hiroyuki Koike, Wendy Thompson, Rebekah Karns, Christopher Mayhew, Patrick S. McGrath, Heather A. McCauley , Ran-Ran Zhang, Kyle Lewis, Shoyo Hakozaki, Autumn Ferguson, Norikazu Saiki, Yosuke Yoneyama, Ichiro Takeuchi, Yo Mabuchi, Chihiro Akazawa, Hiroshi Y. Yoshikawa, James M. Wells,Takanori Takebe
研究者プロフィール
武部 貴則(タケベ タカノリ)Takanori Takebe
東京医科歯科大学 統合研究機構
先端医歯工学創成研究部門 創生医学コンソーシアム 教授
- 研究領域
- 幹細胞生物学、再生医学など
大内 梨江(オオウチ リエ)Rie Ouchi
東京医科歯科大学 統合研究機構
先端医歯工学創成研究部門 創生医学コンソーシアム 特任研究員
- 研究領域
- 幹細胞物学など
お問い合わせ先
研究に関すること
東京医科歯科大学 統合研究機構 先端医歯工学創成研究部門 創生医学コンソーシアム
教授 武部貴則(タケベ タカノリ)
TEL:03-5803-4157
E-mail:ttakebe.ior"AT"tmd.ac.jp
報道に関すること
東京医科歯科大学 総務部総務秘書課広報係
〒113-8510 東京都文京区湯島1-5-45
TEL:03-5803-5833 FAX:03-5803-0272
E-mail:kouhou.adm"AT"tmd.ac.jp
AMED事業に関するお問い合わせ先
国立研究開発法人日本医療研究開発機構(AMED)
戦略推進部 再生医療研究課
〒100-0004 東京都千代田区大手町1-7-1
TEL:03-6870-2220
E-mail:saisei”AT”amed.go.jp
戦略推進部 感染症研究課
TEL:03-6870-2225
E-mail:kansen”AT”amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
掲載日 令和元年5月31日
最終更新日 令和元年5月31日


